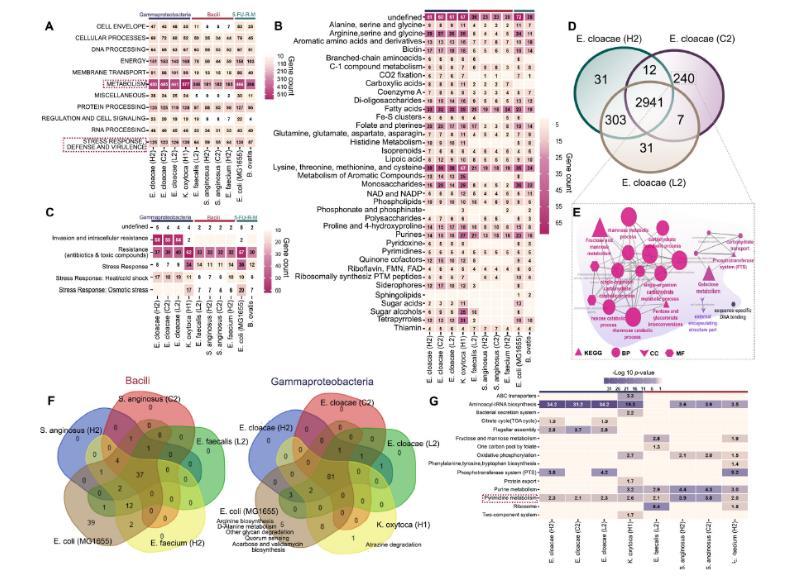
图3、IPMN衍生的γ-变形菌纲菌株比芽孢杆菌菌株功能更丰富。A)使用WGS、RAST和The Seed对IPMN衍生的γ-变形菌纲、芽孢杆菌菌株以及5-FU耐药突变株进行超类途径分析。结果表明与芽孢杆菌相比,γ-变形菌纲的功能更丰富。B和C:使用RAST和The Seed对代谢和应激反应、防御和毒力超类途径进行分析。将IPMN菌株的概况与5-FU耐药突变株进行比较,发现革兰氏阴性菌株中存在一致的富集现象。B-C)使用RAST和The Seed对代谢和应激反应、防御和毒力超类途径进行分析。将IPMN菌株的概况与5-FU耐药突变株(E.coli MG1655和B.ovatis)进行比较,发现革兰氏阴性菌株中存在一致的富集现象。D)使用进化基因基因alogy非监督正交同源群(eggNOG)分析,展示了从低级别异型增生(LGD)、高级别异型增生(HGD)和侵袭性癌症(IC)中分离的E.cloacae菌株的共有和独特表达基因的维恩图。E)使用Cytoscape(19)和网络富集的基因本体(GO)途径进行网络分析,包括生物学过程(BP;椭圆形)、细胞组分(CC;V形)、分子功能(MF;六边形)和京都基因与基因组百科全书(KEGG)途径(三角形)。F)维恩图显示了芽孢杆菌菌株的KEGG途径富集情况:S.anginosus(H2)、S.anginosus(C2)、E.faecalis(L2)、E.faecium(H2)以及5-FU耐药突变株E.coli MG1655。G)KEGG通路在源自胰腺导管内乳头状瘤的γ-变形菌和杆菌菌株中显著富集(P<0.05,经博弗雷诺校正)。嘧啶代谢在所有γ-变形菌和杆菌菌株中均显著富集。
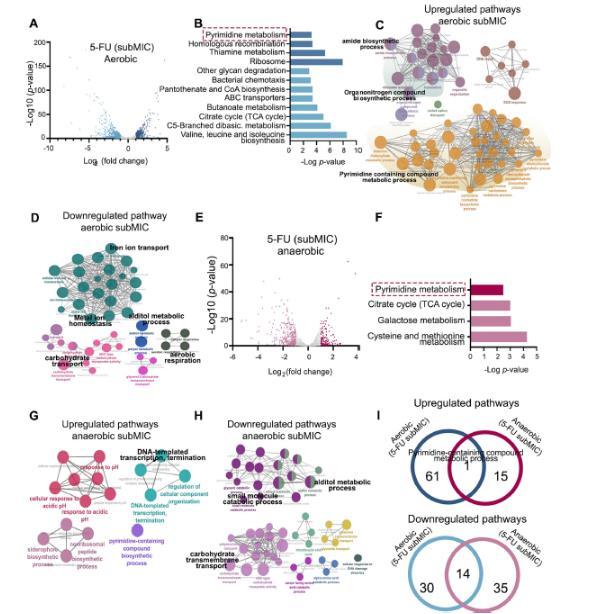
图4、5-FU诱导的E. coli MG1655应答和生存机制的转录组分析。A) 显示E. coli MG1655在有氧条件下暴露于5-FU时的差异表达转录本的火山图。B) 在有氧条件下,5-FU处理后差异表达基因(DEGs)的KEGG途径富集分析。使用Cytoscape识别途径,使用Bonferroni逐步校正确定显著性(P<0.05)。上调途径以深蓝色显示(顶部),下调途径以浅蓝色显示(底部)。C-D) 在有氧条件下,与上调和下调DEGs相关的生物学过程的GO富集分析。分析使用Cytoscape进行,使用Bonferroni逐步校正确定显著性(P<0.05)。E) 显示E. coli MG1655在厌氧条件下暴露于5-FU时的差异表达转录本的火山图。(F)在无氧条件下接受 5 - 氟尿嘧啶治疗后差异表达基因的 KEGG 通路富集分析。(G 和 H)在无氧条件下上调和下调的差异表达基因的生物过程的 GO 富集分析,使用 Cytoscape 并进行博弗雷诺修正法校正(P < 0.05)。(I)展示在有氧和无氧条件下由 5 - 氟尿嘧啶调节的共享 GO 生物过程通路的维恩图。
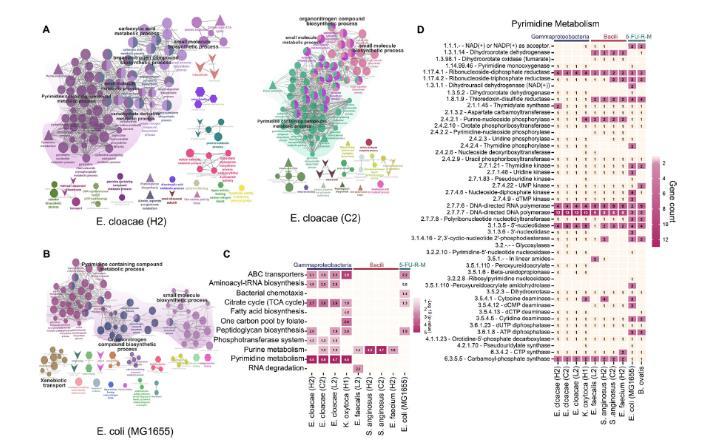
图 5 、功能通路分析揭示了 IPMN 来源菌株中嘧啶代谢的丰富现象,这是其生存机制的一部分。(A)基于特定基因(包括抗生素抗性基因(使用 CARD [23] 进行映射)、药物靶点(Drugbank 和 TTD [24])、毒力因子(VFDB [25] 和 Victors [26])以及转运蛋白(TCDB))的存在情况,对生物过程、分子功能、细胞成分和 KEGG 通路的 GO 术语进行了可视化。(B)采用 Bonferroni 逐步校正法进行富集分析(P < 0.05)。左图:阴沟肠杆菌(H2);右图:阴沟肠杆菌(C2)。(C)对所有 IPMN 来源的γ-变形菌和杆菌菌株的 KEGG 通路富集情况(P < 0.05 Bonferroni 逐步校正)。(D)使用酶分类号(EC)编号和基因计数,利用 PATRIC BVBRC 数据库重建了来自 IPMN 的γ-变形菌、杆菌和 5-FU 抗性突变菌株(大肠杆菌 MG1655 和 B. ovatis)的嘧啶代谢通路。
总结
胰腺癌(PC)仍然是最具致死性的恶性肿瘤之一,其治疗效果有限。尽管手术切除是最有效的治疗选择,但化疗药物如5-氟尿嘧啶(5-FU)和吉西他滨可能会提高患者的生存率。胰管内乳头状黏液性肿瘤(IPMNs)是胰腺囊性肿瘤,也是胰腺癌筛查中经常检测到的重要前体病变。越来越多的证据表明,IPMNs可能含有独特的肿瘤微生物组,但这些微生物的持久性及其对癌症治疗的潜在影响尚不清楚。在本研究中,研究人员分析了来自临床IPMN样本的细菌分离株,并通过功能性实验和全基因组测序(WGS)研究了它们与化疗药物的相互作用。大多数分离株降低了5-FU和吉西他滨对胰腺癌细胞系(PANC-1、AsPC-1和Capan-2)的细胞毒性。WGS显示,与芽孢杆菌相比,γ-变形菌纲菌株在与抗生素抗性、药物运输和毒力相关的基因上更为丰富。进一步的通路分析表明,γ-变形菌纲在嘧啶代谢通路中更为丰富,而芽孢杆菌在嘌呤代谢通路中更为丰富。这些发现表明,IPMN相关细菌具有代谢活性,能够调节化疗药物的疗效。研究结果表明,支持细菌在肿瘤病变内生存的微生物适应机制也使它们能够与嘧啶类似物相互作用。这强调了阐明肿瘤相关微生物群在调节肿瘤微环境和治疗中的功能角色的重要性。本研究提供了新的见解,扩展了以往主要关注肠道微生物的研究。
Bioscreen C全自动生长曲线分析仪在本论文中发挥了不可或缺的作用,不仅提供了精确的细菌生长数据,还为后续的药物敏感性测试和基因组分析提供了重要的基础。通过这些数据,研究人员能够更深入地理解IPMN衍生细菌的生长特性和适应机制,从而为胰腺癌的治疗提供了新的视角和潜在的干预靶点。本研究结果不仅揭示了IPMN相关细菌的代谢途径,还为理解肿瘤相关微生物如何适应肿瘤微环境并影响化疗药物的代谢提供了重要依据。这些发现对于开发新的治疗策略和提高胰腺癌患者的治疗效果具有重要意义。
