2.4病毒拯救
收获转染后的病毒接种至新的BHK-21细胞,48 h后反复冻融细胞,收获F1代病毒。将F1代病毒连续盲传至F3代,在显微镜下观察细胞状态。结果(图4)显示,出现典型的CPE,细胞收缩变圆,有的开始脱落,而对照细胞无变化。将拯救病毒命名为rSVA。

图4病毒拯救显微镜观察结果
2.5拯救病毒鉴定
F5代rSVA分节段PCR扩增结果(图5)显示,成功扩增出预期大小的SVA全基因组序列的7个片段。经测序鉴定,测序结果与亲本毒株高度同源。
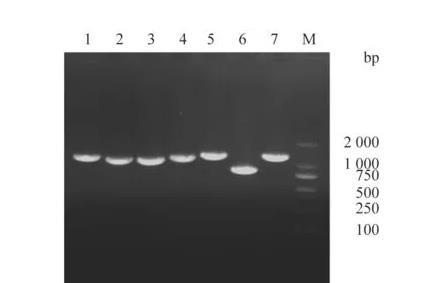
图5拯救病毒分节段PCR鉴定结果
2.6生长曲线分析
为比较拯救病毒与亲本病毒的复制能力与增殖特性,绘制病毒生长曲线(图6),发现两种病毒的复制能力与增殖特性相似,无明显差异。
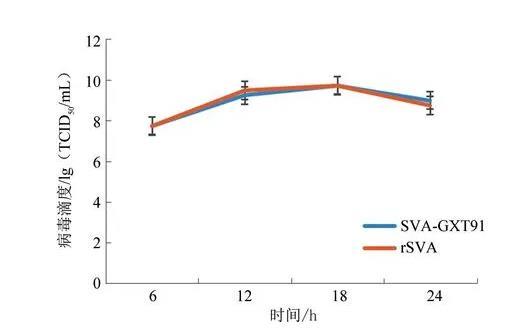
图6 rSVA与亲本病毒生长曲线
2.7间接免疫荧光试验
对亲本病毒与拯救病毒进行间接免疫荧光试验。结果(图7)显示:感染BHK-21细胞18 h后,亲本病毒与拯救病毒在荧光显微镜下均能显示出特异性的绿色荧光,而对照细胞没有绿色荧光产生。
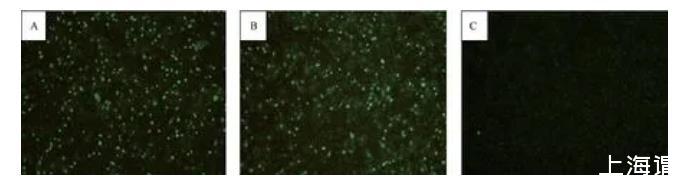
图7间接免疫荧光试验结果
2.8噬斑形成试验
接种至BHK-21细胞后,rSVA与亲本病毒均能产生明显的噬斑(图8),且噬斑大小及形态基本一致,表明拯救病毒与亲本病毒具有相似的噬斑形成能力。
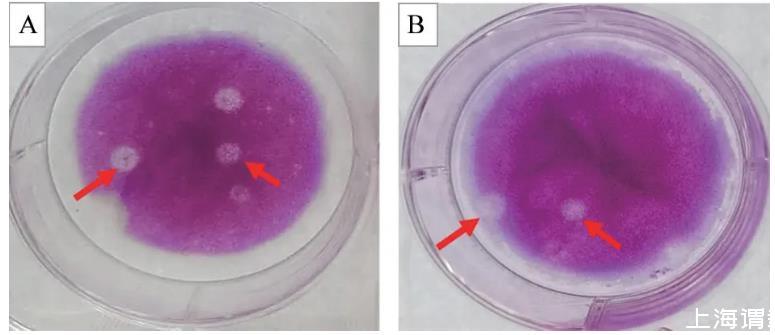
图8噬斑试验结果
3讨论
SVA最初从被污染的PER.C6细胞系中分离得到。污染物被认为源自胎牛血清或猪胰蛋白酶,早期作为溶瘤病毒而受到关注。2015年SVA在广东省某猪场首次被发现并报道,随后逐渐蔓延至我国多个省份。SVA可引起与FMD等水泡病类似的临床症状并造成巨大经济损失。据报道,近年来SVA在我国流行分布较广泛,其诊断目前主要依赖于病原学及血清学检测,在防控方面尚未开发出商业化疫苗。
反向遗传操作技术在反转录病毒的分子特性研究中是一项重要工具,为RNA病毒在遗传特性、疫苗构建等方面奠定了重要基础。为快速构建SVA感染性克隆平台,本试验采用快速一步法,即将SVA全长基因组序列一次扩增,并与设计的CMV启动子、poly(A)+HDVr基因相连接,同时基因上的同源臂保证3段基因能够依次插入线性化的低拷贝质粒中。在同源重组酶催化下,37℃反应30 min即可一步完成同源重组结合,实现体外环化,将构建好的重组质粒pWSK-29-SVA直接转化感受态细胞,经菌落PCR鉴定,质粒构建正确。
重组质粒转染BHK-21细胞后,第1代病变不明显,在盲传3代后可出现明显CPE,表现为细胞圆缩、脱落,初步表明病毒拯救成功。本研究在盲传至第5代时进行病毒拯救鉴定,此时能够降低感染性克隆质粒干扰,同时使用含有去除DNA的反转录试剂盒可以清除残存质粒。通过RT-PCR方法分7段扩增病毒基因,并分别对扩增子进行正反两向测序,发现测序结果与亲本毒株一致。为研究拯救毒株与亲本毒株生物学特性的差异,本试验比较了F5 rSVA与亲本第5代SVA的生长动力曲线,结果表明拯救毒株与亲本毒株生长动力曲线基本一致。噬斑形成试验显示,拯救毒株与亲本毒株产生噬斑大小、形状基本一致,表明一步法构建SVA感染性克隆平台准确有效。
病毒感染性克隆的关键在于全长cDNA构建,SVA基因组长度较短(约7.3 kb),为单股正链RNA。本研究在构建感染性克隆过程中使用高保真DNA聚合酶,这样能够高效扩增基因组,并且可有效避免出现突变。但当片段长度大于5 kb时聚合酶的错误率呈指数级上升,因此对于较长的基因组,若担心长片段扩增导致保真度降低,可将病毒基因组分成多节段进行扩增,同时设计好同源臂并确保连接正确,这样也可实现快速质粒构建。
