1.3 方法
1.3.1 动物双歧杆菌NX-6的菌株特性测定
1.3.1.1 生长曲线测定
取—80 ℃冻存的动物双歧杆菌NX-6解冻后接种于BS固体培养基上,置于厌氧工作站中(温度37 ℃、相对湿度65%、氧气相对含量0.0%)培养24 h,挑取单个菌落接种于BS液体培养基中继续培养24 h,设置3 个平行组,每2 h取样于600 nm波长处测定OD值,绘制生长曲线。
1.3.1.2 人工胃肠液耐受实验
取—80 ℃冻存的动物双歧杆菌NX-6解冻后接种于BS固体培养基,放置于厌氧工作站中(温度37 ℃、相对湿度65%、氧气相对含量0.0%)培养24 h,挑取单菌落接种于BS液体培养基中继续培养24 h作为种子液。取10 mL种子液离心(6 000 r/min、4 ℃)10 min弃去上清液得菌泥,用磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2 次后将菌泥重悬于人工胃液(或人工肠液)中,37 ℃消化3 h,在厌氧工作站中分别于0 h和3 h取样,调整菌悬液浓度为10—6~10—7 CFU/mL,涂布于BS固体培养基上培养24 h后测定活菌数,按式(1)计算存活率:
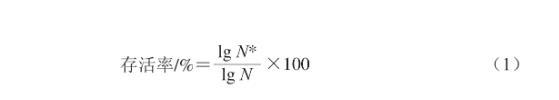
式中:N为0 h时NX-6的活菌数/(CFU/mL);N*为3 h时NX-6的活菌数/(CFU/mL)。
1.3.1.3 菌株全基因组学测序、组装和注释
取一定量动物双歧杆菌NX-6种子液离心并用PBS洗涤菌泥2 次,再次离心弃去上清液,将菌体送至苏州金唯智生物科技有限公司进行全基因组测序,具体步骤包括提取基因组DNA、基因组打断、末端修复、加测序接头、纯化DNA和上机测序。对测序结果进行基因组装分析、基因组注释、基因功能注释、特殊结果预测,其中基因功能注释使用了非冗余蛋白质数据库、京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库、直系同源集(Cluster of Orthologous Groups,COG)数据库、碳水化合物酶相关的专业数据库、蛋白质家族数据库、致病菌毒力因子(Virulence Factors of Pathogenic Bacteria,VFDB)数据库等。
1.3.2 斑马鱼降脂功效实验
1.3.2.1 样品配制
用二甲基亚砜(dimethyl sulfoxide,DMSO)配制质量浓度为24 mg/mL的阿托伐他汀钙母液,置于4 ℃冰箱备用。实验时调整阿托伐他汀钙溶液质量浓度为2.4 μg/mL;称取0.5 g油红O加入100 mL 1,2-丙二醇溶液中,常温下用磁力搅拌器避光搅拌8 h,充分溶解,再用定性滤纸过滤染液,配成新鲜油红O染液;养殖水配制质量分数为1%葡萄糖溶液;取1.3.1.2节的种子液2 mL,在4 ℃、6 000 r/min条件下离心10 min弃上清液得菌泥,用PBS洗涤2 次,E3养殖水重悬,分别配制成浓度分别为1×104、1×105、1×106 CFU/mL的动物双岐杆菌NX-6菌液用于后续实验。
1.3.2.2 模型构建与药品干预
将每组25 尾受精后5 h的斑马鱼置于6 孔板中,空白组加入4 mL E3养殖水并投喂斑马鱼鱼苗正常饲料,其余组加入4 mL葡萄糖溶液并投喂斑马鱼高脂饲料,28 ℃孵育5 d,每天更换新的溶液。完成模型构建后,弃去上述溶液,空白组和模型组加入4 mL E3养殖水,阳性组加入4 mL阿托伐他汀钙溶液,NX-6低浓度组加入4 mL菌液(1×104 CFU/mL),NX-6中浓度组加入4 mL菌液(1×105 CFU/mL),NX-6高浓度组加入4 mL菌液(1×106 CFU/mL)。各组于28 ℃孵育72 h,每孔每天投喂5 mg饲料并更换新鲜溶液,除空白组喂食斑马鱼正常饲料外,其他组均继续投喂高脂饲料,通过油红O染色情况和TG、TC检测结果判定高脂模型构建是否成功。
1.3.2.3 油红O染色
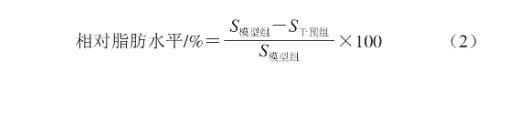
孵育结束后使用E3养殖水冲洗幼鱼,将幼鱼收集于1.5 mL离心管中,加入1 mL 4%多聚甲醛溶液,4 ℃固定1 d。将离心管中固定的幼鱼倒入24 孔板中,E3养殖水冲洗2 次,用不同体积分数的1,2-丙二醇溶液按以下顺序进行渗透:25% 1,2-丙二醇溶液处理25 min→50%1,2-丙二醇溶液处理25 min→75% 1,2-丙二醇溶液处理25 min→100% 1,2-丙二醇溶液处理25 min。加入质量分数为0.5%油红O染液2 mL(幼鱼完全浸没),锡纸避光,室温染色过夜。洗掉染液,加入体积分数为100% 1,2-丙二醇溶液,去背景色20 min(在显微镜下观察去背景的效果)。在显微镜下拍照观察斑马鱼幼鱼染色情况(脂肪细胞和肝脏脂肪变性染色呈红色)。采用ImageJ 6.0软件进行图像分析并采集数据,分析统计斑马鱼尾部血管血脂光密度总和(S),根据光密度总和的统计学结果按式(2)计算相对脂肪水平,以评价动物双岐杆菌NX-6的降血脂作用。
1.3.3 非靶向代谢组学分析
取1 mL NX-6发酵上清液(记为NX组),加1 mL甲醇-乙腈溶液(2∶1,V/V)和35 μL 0.3 mg/mL内标(L-2-氯苯丙氨酸,用甲醇溶液配制),涡旋振荡至无结块的固液混合物。在冰水浴中超声提取15 min,再涡旋振荡10 min,—20 ℃静置20 min。在15 000 r/min、4 ℃条件下离心5 min,取200 μL上清液进样测试。以空白BS培养基作为对照(记为BS组),所有样本的提取液分别取30 μL混合制备成质控样本。色谱柱选用AQUITY UPLC HSS T3柱(100 mm×2.1 mm,1.8 μm)。流动相A为水(含0.1%甲酸),流动相B为乙腈(含0.1%甲酸),梯度洗脱程序:0~1 min,98% A、2% B;1~9 min,98%~2% A、2%~98% B;9~12 min,2% A、98% B;12~12.1 min,2%~98% A、98%~2% B;12.1~15 min,98% A、2% B。流速0.4 mL/min,柱温40 ℃,进样体积4 μL。质谱采用双电喷雾离子源,使用Auto MS/MS采集模式,扫描范围为m/z 500~1 300,干燥气流速为8 L/min,干燥气温度为320 ℃,鞘气流速12 L/min,鞘气温度为350 ℃,毛细管电压为4 000 V,喷嘴电压为1 000 V,碰撞能量为10/40 V。
1.3.4 斑马鱼体内的2-吲哚酮、吲哚-3-甲酸含量测定
随机挑选受精后5 d野生型AB系斑马鱼置于6 孔细胞培养板中,每孔30 尾,设置模型组、BS组、NX-6组,每组3 个重复孔。按上述步骤构建模型,构建结束后正常组加入E3养殖水并投喂正常饲料,模型组加入E3养殖水并投喂高脂饲料,BS组加入空白BS培养基,NX-6组加入浓度为1×106 CFU/mL NX-6菌液并投喂高脂饲料,每孔每天投喂5 mg饲料并更换新鲜溶液,置于28 ℃生化培养箱中孵育14 d。干预结束后,每孔随机挑选20 尾斑马鱼,超纯水洗涤3 次后,转移斑马鱼至1.5 mL EP管中加入PBS并匀浆,取50 µL匀浆液加入300 µL沉淀剂,涡旋5 min混匀后在4 ℃、15 000 r/min条件下离心10 min,取上清液于进样瓶中进行液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析(标准曲线同步操作),运用LC-MS/MS仪检测提取液中2-吲哚酮、吲哚-3-甲酸的浓度。
1.3.5 斑马鱼中TG与TC含量测定
构建高脂血症斑马鱼模型,设置空白组(150 mL 0.01% DMSO+正常饲料)、模型组(150 mL 0.01%DMSO+高脂饲料)、阳性组(150 mL 2.5 μg/mL阿托伐他汀钙溶液+斑马鱼高脂饲料)和实验组(150 mL 1×104、1×105、1×106 CFU/mL NX-6菌液+斑马鱼高脂饲料或25、50、100 μmol/L吲哚-3-甲酸),各组在28 ℃条件下孵育14 d。干预结束后,收集斑马鱼于2 mL EP管中(每组30 尾/管),吸净离心管中的液体,每管加入200 μL PBS,使用组织均质研磨仪将收集到的斑马鱼匀浆破碎,直至无明显组织碎块,4 ℃、10 000 r/min离心10 min后取上清液,按照试剂盒说明书分别测定TG、TC含量。
1.4 数据处理与分析
采用GraphPad Prism 6.0软件统计处理数据,结果用表示。
相关新闻推荐
1、不同温度、盐度、pH、碳源、氮源对嗜水气单胞菌的生长影响(一)
3、A型塞内卡病毒全长感染性克隆、致病机理及生长曲线分析(三)
