2结果与分析
2.1体外抑菌活性
基于MIC、MBC及细菌生长曲线综合评估GD对副溶血弧菌的体外抑菌活性。采用刃天青试验测定GD对副溶血弧菌的MIC,结果显示GD浓度大于7.6 mg/mL时,菌液显蓝色(无细菌生长),表明GD对副溶血弧菌的MIC为7.6 mg/mL(图1A)。吸取MIC以上浓度的各孔菌液进行平板涂布,培养24 h后,发现药液浓度大于15.2 mg/mL时,无菌落长出(图1B),说明该浓度为GD对副溶血弧菌的MBC。
通过测定GD作用下副溶血弧菌菌液的OD600值,绘制32 h内细菌的生长曲线,结果显示3个GD处理组(MIC、1/2MIC、1/4MIC)菌液的OD600值均低于对照组,且药物浓度越高其OD600值越低,其中MIC组的OD600值始终保持在较低水平(<0.1)(图1C),结果表明1/4MIC浓度以上的GD药物能抑制副溶血弧菌的生长。考虑到抑菌机制研究,应选取对细菌生长干扰较小的浓度,因此选取1/4MIC浓度用于后续研究。

图1 GD对副溶血弧菌的MIC(A)、MBC(B)及细菌生长曲线(C)
2.2电镜观察结果
基于扫描SEM和TEM,分析GD对副溶血弧菌细胞结构的影响。结果显示,从扫描电镜图中可见,在无药物处理条件下,副溶血弧菌形态饱满均匀,外形圆润,表面光滑平整(图2A),而在1/4MIC浓度的GD处理后,菌体细胞发生裂解,出现空洞或裂缝,大量胞内泄露物质黏附在细胞表面(图2B);从透射电镜可以看出,未经药物处理的对照组副溶血弧菌细胞结构完整,表面光滑,细胞内容物分布均匀(图2C),而GD处理组菌体细胞壁、细胞膜出现消融,细胞内出现大空泡,细胞质减少且分布不均(图2D)。扫描电镜和透射电镜结果均表明,GD处理可破坏副溶血弧菌细胞结构完整性,影响细胞膜通透性,导致大分子物质泄露。
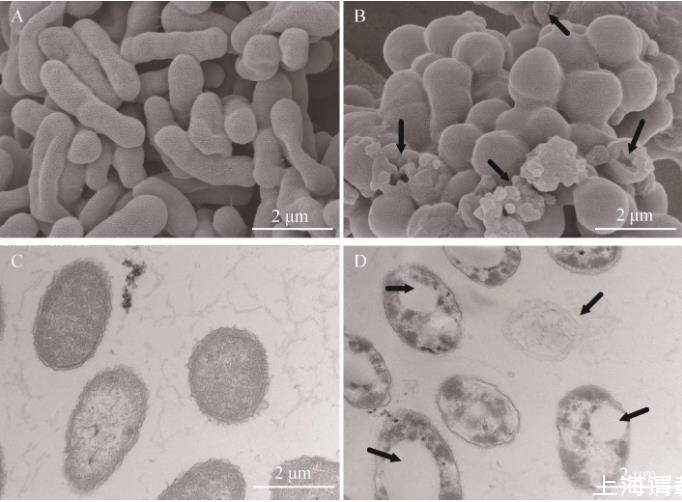
图2副溶血弧菌细胞的扫描电镜图和透射电镜图
2.3转录组数据质控分析
为比较GD处理组和对照组副溶血弧菌转录组的差异,用NovaSeq X Plus平台进行转录组测序,采用统计分析方法对质控后数据进行质量分析。结果显示,质控后所有样品均获得2 000万条以上Clean reads,碱基错误率均低于0.012 0%,质量大于99.90%的碱基占比(Q20)均超过98.76%;将质控后数据与参考基因组进行比对,所有样品的比对率均大于88.80%(表2),表明转录组测序质量可靠。
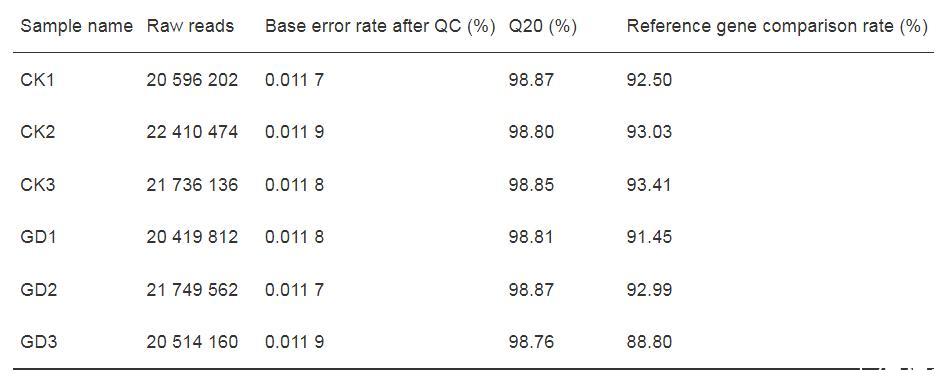
表2质控数据统计
2.4转录组总体差异分析
基于韦恩图分析GD组和CK组副溶血弧菌基因数量的差异,结果显示GD组和CK组分别有76个和83个特有基因,二者有4 501个共享基因(图3A)。主成分分析(PCA)图中可见,GD组和CK组样品沿着解释度高达81.32%的PC1轴明显区分开(图3B),聚类热图也发现两组样品分别单独聚类(图3C),表明GD组和CK组组间存在较大差异,且组内样品的重复性较好。进一步基于DESeq2筛选出两组间差异表达基因,并通过散点图可视化显著变化基因的数量及分布。结果显示,与CK组相比,GD组有1 074个显著上调基因,以及1 179个显著下调基因,另有3 271个基因在两组间无显著差异(图3D)。
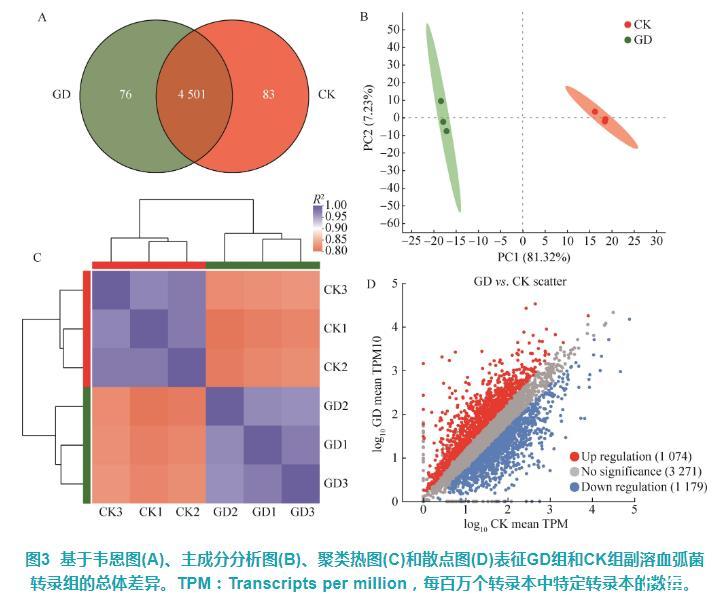
图3基于韦恩图(A)、主成分分析图(B)、聚类热图(C)和散点图(D)表征GD组和CK组副溶血弧菌转录组的总体差异。TPM:Transcripts per million,每百万个转录本中特定转录本的数量。
2.5差异表达基因的GO富集分析
通过goatools软件对GD组和CK组组间差异表达基因进行GO富集分析,结果显示GD组上调基因被显著富集到79个GO功能(P<0.05),通过气泡图展示富集程度前20的GO功能,主要涉及转录因子活性、细胞壁合成代谢等相关功能,包括转录调节因子活性(transcription regulator activity)、DNA结合转录因子活性(DNA-binding transcription factor activity)、肽聚糖生物合成过程(peptidoglycan biosynthetic process)、肽聚糖代谢过程(peptidoglycan metabolic process)、氨基聚糖生物合成过程(aminoglycan biosynthetic process)、氨基聚糖代谢过程(aminoglycan metabolic process)、细胞壁大分子生物合成过程(cell wall macromolecule biosynthetic process)、细胞壁组织或生物发生(cell wall organization or biogenesis)、细胞壁组织(cell wall organization)等(图4A)。GD组下调基因被显著富集到129个GO功能(P<0.05),其中富集程度前20的主要为肌苷酸、核糖核苷合成代谢等相关功能,包括肌酐酸(inosine monophosphate,IMP)生物合成过程(IMP biosynthetic process)、IMP代谢过程(IMP metabolic process)、核糖核苷一磷酸代谢过程(ribonucleoside monophosphate metabolic process)、一磷酸核糖核苷生物合成过程(ribonucleoside monophosphate biosynthetic process)、嘌呤核苷一磷酸代谢过程(purine nucleoside monophosphate metabolic process)、嘌呤核糖核苷一磷酸生物合成过程(purine ribonucleoside monophosphate biosynthetic process)、嘌呤核糖核苷一磷酸代谢过程(purine ribonucleoside monophosphate metabolic process)、核糖磷酸代谢过程(ribose phosphate metabolic process)、核苷酸生物合成过程(nucleotide biosynthetic process)、核糖核苷酸代谢过程(ribonucleotide metabolic process)等(图4B)。
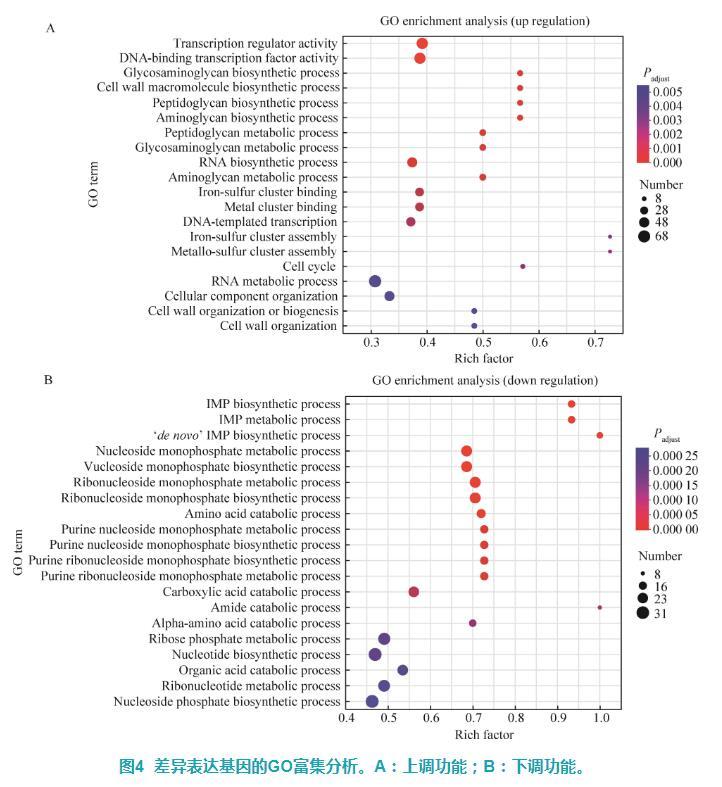
图4差异表达基因的GO富集分析。A:上调功能;B:下调功能。
2.6差异表达基因的KEGG富集分析
采用KOBAS软件对GD组和CK组组间差异表达基因进行KEGG信号通路的富集分析,结果显示GD组上调基因仅被显著富集到肽聚糖生物合成(peptidoglycan biosynthesis)和万福霉素抗药性(vancomycin resistance)等2个KEGG通路(P<0.05)(图5A);GD组下调基因被显著富集到柠檬酸循环(citrate cycle)、氧化磷酸化(oxidative phosphorylation)、嘌呤代谢(purine metabolism)、双组分系统(two-component system)、原核生物的碳固定途径(carbon fixation pathways in prokaryotes)、细菌趋化性(bacterial chemotaxis)等通路(P<0.05)。此外,下调基因还涉及群体感应(quorum sensing)、志贺菌病(shigellosis)、军团菌病(legionellosis)等通路,但这些通路并未达到显著水平(P>0.05)(图5B)。
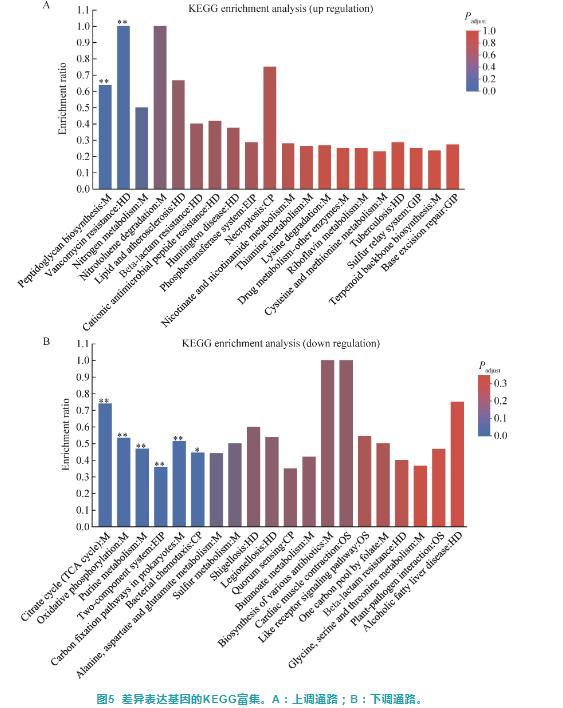
图5差异表达基因的KEGG富集。A:上调通路;B:下调通路。
2.7差异表达基因的RT-qPCR验证结果
为验证转录组测序数据的准确性,随机选取6个显著下调基因(gltD、gltB、hisC、cysE、ftsE和mcp)和6个显著上调基因(VP2355、glgP、ftsY、fhuC、lolD和nrtC)进行RT-qPCR验证试验。结果显示,与对照组相比,氨基酸代谢相关基因(gltD、gltB和hisC)、膜转运相关基因(ftsE)以及细菌趋化性相关基因(mcp)在GD组中均显著下调(P<0.05),此外生物膜形成相关基因(cysE)在GD组中的表达水平也低于对照组,但未达到显著水平(P>0.05)(图6);相反,铁离子转运相关基因(ftsY、fhuC、lolD和nrtC)在GD组中显著上调(P<0.05),此外蛋白质输出相关基因(VP2355和glgP)在GD组中的表达水平高于对照组,但未达到显著水平((P>0.05)(图6)。RT-qPCR验证试验结果与转录组分析结果基本一致,表明转录组数据分析可信度较高。
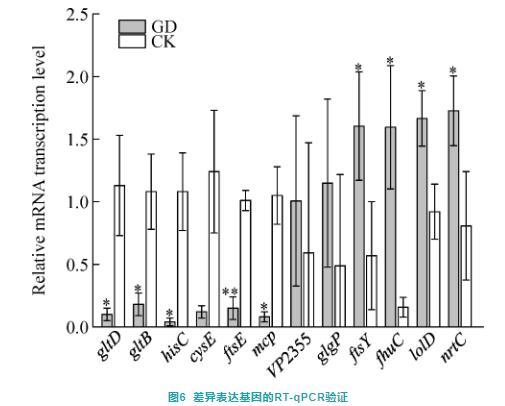
图6差异表达基因的RT-qPCR验证
