由于耐药突变体可以从极低初始比例(10⁻⁴)富集,我们还测试了耐药突变体是否可以从敏感群体新发选择。为此,我们在链霉素最小抑制浓度的1/4下生长鼠伤寒沙门氏菌LT2敏感野生型菌株的20个独立谱系700代,并通过在不同链霉素浓度上铺板连续筛选耐药细胞。在此低抗生素水平下,我们观察到新发耐药突变体的快速富集(图5)。因此,在200至400代内,可以看到耐药性在起始菌株最小抑制浓度的2至16倍(8-64μg/ml)之间的突变体显著富集,并在500至600代后出现高水平耐药突变体(野生型最小抑制浓度的24-32倍=96-128μg/ml)。400代后,所有20个谱系包含最小抑制浓度高于32μg/ml(8倍最小抑制浓度)的亚群体,600代后,14个谱系有最小抑制浓度高于64μg/ml(16倍最小抑制浓度)的亚群体。使用上述方法,在环丙沙星亚最小抑制浓度水平下生长大肠杆菌野生型的20个谱系600代。在最小抑制浓度的1/10下生长500代后,五个谱系有对环丙沙星低水平耐药(最小抑制浓度比敏感亲本菌株高2倍)的亚群体(>1%群体),600代后,二十个谱系中有一个谱系有最小抑制浓度比敏感亲本菌株高8倍的细胞亚群体。
我们还计算了(文本S1中的附录)新发耐药突变体在低抗生素浓度下接管敏感群体的速度,由突变率(u)、群体大小(N)和抗生素存在下的适应性优势(s)决定。s取决于高于MSC的抗生素浓度,如图2和3所示。当无耐药突变体初始存在时,固定时间可表达为
第一项是第一个存活突变体出现的随机等待时间,第二项是随后增长至50%存在的时间。对于小值uN<0.1,第一项主导,固定可能慢。对于大值uN>1,第二项主导,固定可快,约100-1000代,s在0.1-0.01之间(图6)。在此背景下,值得注意的是几种抗生素的亚最小抑制浓度水平,最显著为氟喹诺酮类,已显示增加细菌突变率,可能减少等待时间从而增加突变体接管速率。
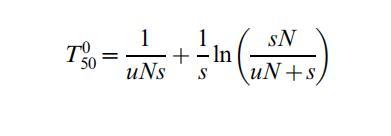
讨论
自然环境中抗生素浓度可广泛变化,取决于特定环境。例如,在污染制药工业或医院污水出口处,浓度可达到极高水平(mg/ml),氟喹诺酮类常达最高水平,而在水体或土壤中水平通常低得多。本文数据表明,即使在那些抗生素浓度极低的环境中,耐药细菌的维持和选择也可能发生。例如,我们实验获得的环丙沙星和四环素的MSC对应100 pg/ml和15 ng/ml,分别类似于某些水体和土壤环境中可发现的浓度。因此,在相对原始环境动物中发现的高频率抗生素耐药细菌可部分由亚最小抑制浓度选择效应富集解释。
这些发现也与耐药性可逆性问题高度相关。由于大多数抗生素耐药机制与适应性成本相关,有人提出如果抗生素选择压力降低,敏感细菌将超过耐药细菌。然而,大多数可用数据表明在社区水平可逆性速率慢或不存在。几种因素可能促成这种不可逆性,包括无适应性成本、通过补偿突变减少适应性成本以及耐药基因与另一受选择基因之间的遗传共选择。此外,本文观察到的亚最小抑制浓度选择可能是这种耐药性长期持久性的重要贡献者,环境中极低抗生素浓度足以通过进一步平衡耐药性的适应性成本来维持群体中现有耐药细菌。这对于正常生命周期涉及在土壤环境中生长(如铜绿假单胞菌)或周期性在水体环境中生长(如大肠杆菌)的细菌病原体尤其重要。
从图2B、D和图3B、D、F、H中图的斜率我们可以推断耐药突变体的适应性成本对MSC值有主要影响。此成本必须首先由抗生素对敏感细菌的负面影响克服,耐药细菌才会被选择,使MSC向更高浓度移动。减少此成本将使曲线上移并降低MSC。同样明显的是突变体增加的耐药性(敏感最小抑制浓度和耐药最小抑制浓度之间的差异)或耐药模式(点突变或外排泵)对MSC的影响相对于适应性成本较小。由于我们的数据在明确遗传背景中获得,具有针对测试抗生素常见的单点突变或缺失,适应性成本代表新发耐药突变的成本。然而,在大多数临床发现的耐药菌株中,耐药性的适应性成本常通过次级突变补偿而不丧失耐药性。这种适应性补偿已针对许多不同抗生素的耐药性描述,包括氟喹诺酮类和链霉素。这意味着此类补偿耐药菌株将被选择的抗生素浓度可能比我们此处测量的更低。
我们及他人发现的另一重要含义是广泛使用的突变体选择窗口概念需要修改。因此,在药效学中通常假设低于最小抑制浓度的抗生素浓度不赋予选择,且突变体选择窗口——耐药突变体被富集的浓度范围——延伸在敏感野生型最小抑制浓度和耐药突变体最小抑制浓度之间。然而,我们的结果暗示生物学相关的亚最小抑制浓度选择窗口更宽,需要包括敏感最小抑制浓度数百倍以下的抗生素浓度(图1A)。此外,本文描述的方法论可用于探测不同环境中生物学活性抗生素浓度,包括例如动物模型。因此,通过在用不同抗生素浓度处理的动物中进行遗传标记敏感和耐药菌株之间的竞争,可以从耐药细菌富集速率推断细菌生长位点的生物学活性抗生素浓度。
在菌株最小抑制浓度以上选择时,选择的主要驱动力是抗生素耐药性,而突变的适应性成本较不重要。即使成本非常高的突变也会被选择,因为敏感细菌形式的竞争者将被消除。然而,在亚最小抑制浓度水平下,情况不同,因为敏感细菌不会死亡,只会生长更慢。因此,赋予高适应性成本的耐药突变不会被富集;只有适应性成本低于抗生素在敏感细菌中引起的生长减少的突变才具有竞争力。这表明在此类条件下可能富集新的低成本或无成本耐药突变谱系。图5数据显示,现有耐药突变体的浓度,但它们也可以从敏感群体新发选择耐药突变体。有趣的是,尽管使用低抗生素浓度,高水平耐药突变体被富集。由于用于新发突变体选择的链霉素浓度与野生型和rpsL K42R突变体竞争确定的MSC相同,富集的耐药细菌很可能携带适应性成本显著低于先前研究的rpsL突变的耐药突变。
在呈现实验中,预存突变体在与敏感菌株竞争中快速富集。从数学模型我们可以推断新发耐药突变体的类似情况,尤其是在大群体中uN>1且抗生素浓度0.01<s<1.0时。在这些情况下,耐药突变体快速出现,并在100-1000代生长内接管群体。模型得到图5和图S2所示实验支持,其中新发突变体在亚最小抑制浓度抗生素存在下生长600-700代期间频率持续增加。
总之,本文数据表明许多自然环境中存在或治疗期间在某些体腔室中产生的极低抗生素水平与预存耐药突变体的富集和维持以及新突变体的新发选择相关。这些结果强调引入减少环境中抗生素水平和使用避免长时间亚最小抑制浓度抗生素水平的治疗剂量方案的重要性。
