为此,他们优化了一个大肠杆菌表达系统,表达了一个BA转运蛋白基因baiG以增加BA吸收,并删除了内源性7α-HSDH基因以避免干扰。通过从统一的人类和哺乳动物胃肠道蛋白质目录(UHGP/UMGP)中筛选候选HSDH基因,并使用EFI-EST工具构建序列相似性网络,最终选择了207个候选基因进行表达。在初步筛选中,发现其中74个基因表现出BA HSDH活性。通过向含有功能性HSDH基因的大肠杆菌文库中添加46种BA标准品并使用液相色谱-质谱(LC-MS)监测其转化过程,确定了新形成的胆汁酸相关质谱峰是否为先前未充分表征的胆汁酸,并基于其代谢功能和底物特异性分配其身份。
2.肠道菌群编码未被充分表征的胆汁酸羟基类固醇脱氢酶,这些酶可产生较少被研究的胆汁酸异构体
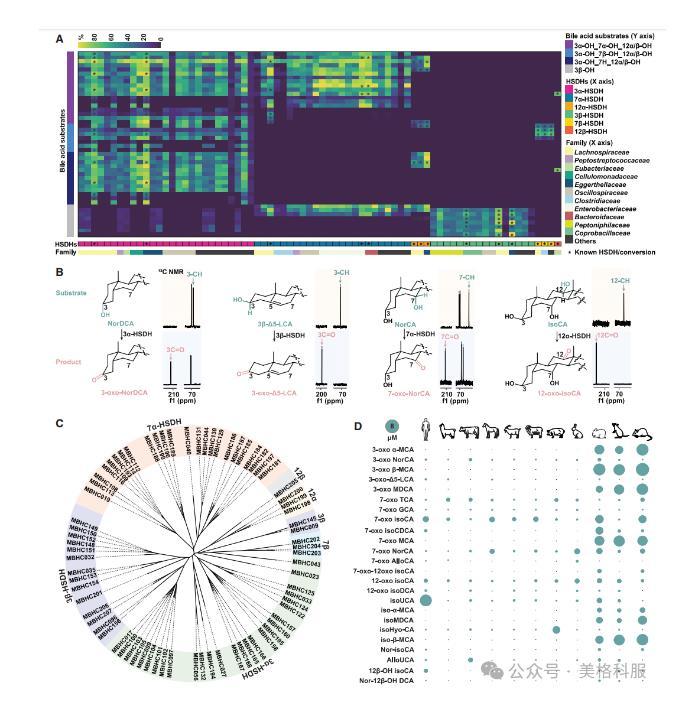
接着研究人员通过对74个HSDH基因(其中59个为首次报道)的功能筛选,鉴定了56种此前未被充分描述的胆汁酸异构体,并通过核磁共振(NMR)验证了这些化合物的身份及相应HSDH的氧化还原功能。研究发现,尽管这些HSDH具有相似的催化功能,但其蛋白质序列多样性显著,例如Enterocloster clostridioformisATCC 25537中的3α-HSDH(MBHC01/XMLSchema)与Bacteroidales bacterium22bG中的另一个3α-HSDH(MBHC043)仅有19%的序列相似度。此外,HSDH基因能够代谢广泛的胆汁酸底物,转化效率从2%到超过90%不等,显示出对不同位置和方向羟基的选择性。这些HSDH广泛分布于人类肠道细菌中,超过40%的人类肠道细菌物种至少携带一个与HSDH同源的基因。进一步分析显示,这些未充分表征的BA异构体在哺乳动物粪便样本中普遍存在,如3-oxo-NorCA和12-oxo-isoCA,浓度范围为0.1至5 mM,在所有脊椎动物哺乳类中均检测到。某些胆汁酸如3-oxoα-MCA和3-oxoβ-MCA则特异性存在于啮齿类动物中。研究结果表明,每种哺乳动物物种都有独特的BA指纹景观。
3.胆汁酸可拮抗人类雄激素受体

为了进一步鉴定以前未知的BA介导的宿主信号通路和生物学,研究通过细胞基础的荧光素酶报告基因检测,筛选了56种未充分表征的BAs,并发现其中3-oxo-D5-LCA是一种有效的hAR拮抗剂,IC50值为119.4 nM(或443 nM,使用15 pM二氢睾酮[DHT]作为激动剂)。此外,其他几种已知BAs如3-oxo-D4-LCA和3-oxo-D4,6-LCA也表现出显著的AR拮抗活性,IC50值分别为133.6 nM和99.7 nM(同样以15 pM DHT作为激动剂)。这些BA通过平面化的A/B环与AR配体结合域(AR-LBD)中的Trp741相互作用,并通过C3羰基和C24羧基形成氢键,进一步稳定结合。分子对接实验支持了这一观察结果。更重要的是,这些BA不仅抑制AR依赖基因(如PSA、KLK2和TMPRSS2)的表达,还在LNCaP和C4-2前列腺癌细胞系中有效抑制了细胞增殖,其效果可与临床使用的AR拮抗剂enzalutamide媲美。此外,这些BA还能够抑制DHT诱导的AR核转位,表明其拮抗活性部分源于阻止AR进入细胞核。
4.拮抗雄激素受体的胆汁酸来源于微生物群,与人类相关
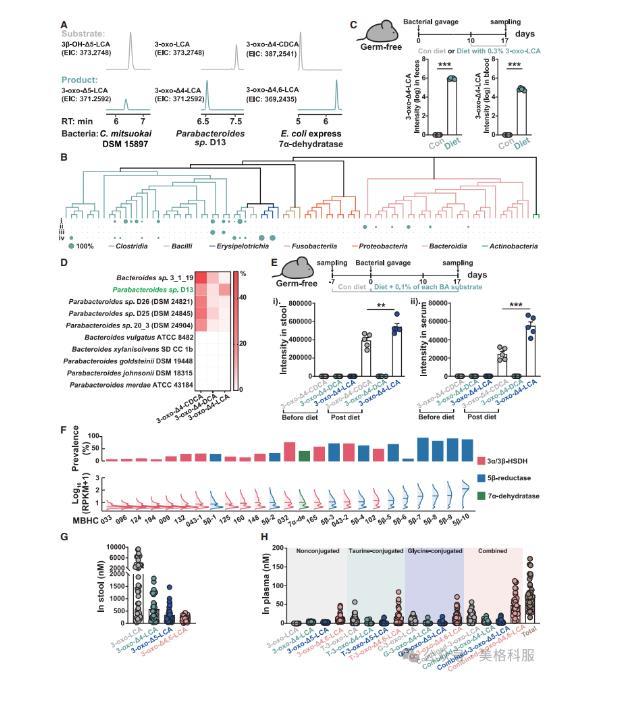
本研究通过多方面证据证实,拮抗雄激素受体(AR)的胆汁酸(BAs)由肠道微生物群依赖性途径生成,并在人体中具有生理相关性。首先,多种人类肠道共生菌(如Parabacteroidessp.D13和C.mitsuokai)在体外能够高效生成这些BA代谢物,且在定植于无菌小鼠模型中时也能产生显著水平的3-oxo-D4-LCA。其次,宏基因组分析显示,参与合成这些AR拮抗性BAs的关键基因(如5β-还原酶和3α/3β-HSDH基因)在健康人群中广泛存在,尽管其相对丰度在不同个体间存在显著差异。最后,代谢组学分析表明,这些BAs在人体粪便中的浓度范围可达0–925μM,在血清中也可达0–250 nM,显示出其在人体内的普遍存在性和浓度变异性。这些结果共同支持了肠道微生物在调节宿主激素信号通路中的关键作用。
相关新闻推荐
1、伤寒沙门菌t4606基因缺陷株在高渗应激环境下的生长曲线(一)
3、微生物生长曲线分析仪评估藤黄微球菌角蛋白酶生产条件及分解潜力(四)
