失活ccpA不会消除CCR。为了确定fruA对CCR敏感性的潜在基础,在补充了0.05%葡萄糖和0.5%菊粉的TV培养基中培养戈登氏链球菌DL1和源自DL1的ccpA突变体(图1)。DL1表现出典型的二次生长,而ccpA突变体达到的生长水平与fruA突变体观察到的水平相当。戈登氏链球菌的ccpA突变体在单独葡萄糖上生长几乎与亲本菌株一样好,因此看来ccpA突变体失去了利用菊粉的能力。为了研究CcpA在戈登氏链球菌fruA和levDEFG基因CCR中的作用,将PfruA-cat和PlevD-cat融合引入ccpA突变体,并在各种生长碳水化合物中测量CAT活性(表3和4)。与ccpA突变体在葡萄糖和菊粉组合上的生长表型一致,当细胞在菊粉上生长时,fruA在ccpA突变体中的表达降低了约120倍。在测试的所有五种碳水化合物中,ccpA突变体中levD的表达均较低。因此,与戈登氏链球菌ccpA突变体在菊粉上生长不良(图1)一致,CcpA的失活可能导致菊粉诱导的fruA和levD表达的强烈抑制。由于已知CcpA可以作为某些基因和操纵子的转录激活因子,因此有可能CcpA的缺失导致fruA和levD表达激活的缺乏。
可以观察到CcpA对fruA表达的抑制效应,但对levD没有。在变形链球菌中,fruA和levD操纵子的表达由四组分调节系统LevQRST控制,该系统感应诱导底物果糖或甘露糖的存在。由于相对占主导地位的CcpA非依赖性CCR机制的调节,通过CcpA对变形链球菌fruA的CCR仅在果糖脉冲实验中监测表达时才明显(3)。也就是说,只有当细胞在非诱导碳水化合物中生长到指数中期,然后对培养物进行1到3小时的诱导剂脉冲时,才能观察到CcpA介导的CCR证据。在类似的实验中,携带PfruA-cat或PlevD-cat融合的戈登氏链球菌在含有0.5%葡萄糖的TV中孵育至指数早期(OD600≈0.2),然后用不同浓度的果糖或菊粉处理3小时,然后收获进行CAT测定。如表5所示,当果糖浓度从0.05 mM增加到7.5 mM时,fruA表达增加了约5倍,PlevD-cat菌株对果糖的存在有明显的剂量依赖性反应(表5)。类似地,当使用菊粉脉冲这些菌株时,随着菊粉的添加,levD的表达出现浓度依赖性增加。
由于菊粉是果糖的聚合物,对fruA和levD的诱导效应可能源于FruA降解菊粉并释放游离果糖,后者作为诱导信号。构建了一个fruA敲除突变体,并在突变体中测试了菊粉诱导PlevD::cat表达的能力。如表5所示,用菊粉没有观察到高于阴性对照(无菊粉)水平的诱导,尽管该菌株仍然对果糖诱导有反应(表5)。因此,与变形链球菌一样,菊粉本身似乎不是levD表达的诱导信号,而是从菊粉水解中释放的果糖似乎作为最有效的诱导信号(表2)。值得注意的是,在这两种生物中,由FruA从菊粉中释放的果糖稳态水平仍然低于引发显著CCR所需的水平。
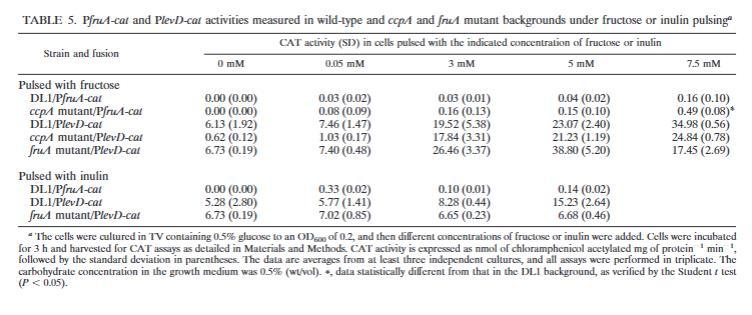
当评估PfruA-cat和PlevD-cat融合在果糖脉冲下的表达时,在ccpA突变体中fruA出现了2到5倍的去抑制(表5)。然而,在相同条件下,ccpA突变体中levD的表达总是低于野生型背景中测量的水平。值得注意的是,在fruA或levD的启动子区域附近无法检测到明显的CRE序列。
破坏酶IIMan(manL)消除了fruA和levD的CCR。鉴于ManL在变形链球菌CCR中的重要性,在戈登氏链球菌中构建了manL缺失,并研究了其对CCR的影响。当测试该突变体在含有0.05%葡萄糖和0.5%菊粉的TV培养基中的二次生长时,二次生长几乎被消除(图1)。
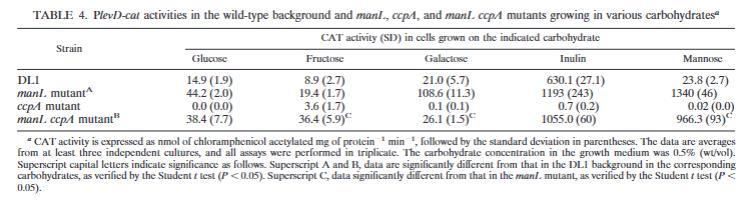
当在manL突变体背景下使用PfruA-cat和PlevD-cat融合测量fruA和levD基因表达时(表3和4),在所有测试的碳水化合物中,这两个基因相对于野生型背景中的表达水平均出现去抑制。根据levD表达的数据,在甘露糖培养物中观察到的去抑制水平最高。虽然在葡萄糖和半乳糖中观察到相似的表达变化倍数,但在果糖作为生长碳水化合物时,ManL缺陷菌株中观察到的去抑制量最低。当细胞在TV-菊粉中生长时,与野生型背景相比,在manL突变株中观察到两个基因的去抑制约为3倍。
CcpA负向调节manL表达。由于我们已经证明破坏CcpA会导致大多数条件下fruA和levD表达降低(表3和4),并且ManL的缺失通常导致CCR的解除,因此CcpA可能通过调节manL间接影响CCR,这似乎是变形链球菌中的情况(54)。将ccpA缺失引入manL突变株,并监测双突变体背景中PfruA-和PlevD-cat融合的表达。当在补充了0.5%葡萄糖、果糖、半乳糖、菊粉或甘露糖的TV中生长时,ccpA manL双突变体产生的CAT活性显著高于野生型菌株或ccpA突变体(表3和4)。与仅携带manL突变的菌株相比,在ccpA manL双突变体中观察到的去抑制水平相似。然而,当使用半乳糖或甘露糖培养细胞时,双突变体显示出较低的活性(表3和4)。这些结果支持了CcpA可能通过影响细胞中ManL的量来影响fruA和levD表达的观点。
为了进一步测试CcpA是否调节manL表达,构建了PmanL-cat融合并将其引入野生型和ccpA突变株。在葡萄糖、果糖或半乳糖中生长时,ccpA突变体中PmanL-cat融合的表达显著高于野生型背景(表6),这一发现表明CcpA对manL的负向调节。同样值得注意的是,在野生型背景中,半乳糖中的manL表达高于葡萄糖或果糖,这可能是因为与葡萄糖或果糖相比,半乳糖通过CcpA诱导CCR的效率较低。半乳糖应流经戈登氏链球菌的塔格糖途径,产生的葡萄糖-6-磷酸(G-6-P)和果糖-1,6-二磷酸(F-1,6-bP)少于在葡萄糖或果糖上生长。由于G-6-P和F-1,6-bP是HPr激酶的激活剂,因此在半乳糖上生长的细胞中,CcpA依赖的manL抑制将不那么严重。与这一概念一致,在缺乏CcpA的菌株中,manL对不同糖的反应表达水平差异很小(表6)。

ccpA突变体中fruA和levD启动子活性降低的另一个可能原因是磷酸载体蛋白HPr的磷酸manL的自调节。为了研究戈登氏链球菌的ManL是否能够影响manL的表达,在manL突变体中测量了PmanL-cat融合的活性。结果(表6)表明,当在半乳糖中生长时,manL启动子的表达相对于野生型菌株在manL突变体中去抑制,尽管在葡萄糖或果糖中生长时观察到的变化要小得多。同样,这种差异可能源于这些糖诱导CCR效率的差异。事实上,当在manL ccpA双突变体中测定manL表达水平时,在所有测试的糖中表达都高度去抑制,表明不同糖中表达差异与葡萄糖和果糖中相比半乳糖中更有效的CcpA依赖性CCR对manL的抑制有关。在manL的启动子区域还鉴定出一个潜在的分解代谢物响应元件(CRE;TGAAAACG TTTTAT),它与革兰氏阳性菌中的共有CRE序列(TGWNANCGNTNWCA)仅略有不同。值得注意的是,我们团队的成员最近观察到变形链球菌中的ManL可以影响manL操纵子的表达(L.Zeng and R.A.Burne,未发表数据)。
相关新闻推荐
1、猪流行性腹泻病毒生长曲线的测定及盐霉素对其抑制效果(五)
2、橄榄苦苷体外抗氧化活性、抑菌活性分析及对细菌生长曲线的影响
