材料与方法
碳源。
测定了八种不同碳水化合物的微生物发酵谱:2'-FL(CARE4U 2'FL,DuPont Nutrition&Biosciences,芬兰坎特维克)、3-FL(CARE4U 3FL,DuPont Nutrition&Biosciences,丹麦布拉伯兰)、DFL(DuPont Nutrition&Biosciences,芬兰坎特维克)、岩藻糖(DuPont Nutrition&Biosciences,芬兰坎特维克)、市售Bimuno GOS(由Clasado Biosciences友情提供,英国圣赫利尔,泽西岛)、相同的富含寡糖的GOS产品(见下文纯化低聚半乳糖制备部分)、乳糖(Merck,德国达姆施塔特)和a-D-葡萄糖(J.T.Baker,荷兰代芬特尔)。碳源的详细信息见表1。将每种碳源的10%(w/v)储备悬浮液在无菌Milli-Q水中制备,然后进行无菌过滤(0.2μm Minisart,Sartorius AG,德国哥廷根),并在-20°C储存直至使用。
| 碳水化合物 | 类型 | 缩写 | 纯度 | 供应商 |
|---|---|---|---|---|
| 2'-岩藻糖基乳糖, Fuc a1-2 Galβ1-4 Glu | 三糖 | 2'-FL | 2'-FL 99% | 杜邦营养与生物科学公司 |
| 3-岩藻糖基乳糖, Galβ1-4 Glu a1-3 Fuc | 三糖 | 3-FL | 3-FL 96%, 乳糖 2.5%, 半乳糖 0.3% | 杜邦营养与生物科学公司 |
| 二岩藻糖基乳糖, Fuc a1-2 Galβ1-4 Glu a1-3 Fuc | 四糖 | DFL | DFL 97%, 3-FL 0.1%, 2'-FL 2.1% | 杜邦营养与生物科学公司 |
| 岩藻糖 | 单糖 | Fuc | 岩藻糖 99.5% | 杜邦营养与生物科学公司 |
| Bimuno GOS | 多糖 | GOS-c | GOS 81%, 葡萄糖 5.4%, 乳糖 12.3% | Clasado Biosciences |
| 乳糖 | 二糖 | Lac | 用于微生物学 | Merck |
| 葡萄糖 | 单糖 | Glu | ACS级 | J.T. Baker |
细菌生长的测量。
使用自动Bioscreen C系统(Labsystems,芬兰赫尔辛基)测量细菌菌株在不同碳水化合物底物上的生长,如前所述。将Bioscreen C系统放置在厌氧柜(80%N2,10%CO2,和10%H2)内,以便在厌氧条件下进行细菌生长。简而言之,将20μL每种碳水化合物(10%)或葡萄糖(10%)溶液加入板孔中,并将孔中加入含有单一类型微生物(1%v/v)的细胞悬浮液(180μL)(参见上文微生物培养物的制备方法)。因此,每个孔中碳水化合物底物的最终浓度为1%(w/v)。葡萄糖用作非选择性阳性对照底物。不含任何添加碳水化合物的培养基用作阴性对照,以确定微生物在没有添加碳源的情况下的生长;对于这些孔,使用20μL无菌Milli-Q水代替碳水化合物,然后加入180μL微生物悬浮液。将细菌在37°C或30°C下培养24小时,每30分钟测量一次600 nm处的光密度。在测量前将板摇晃10秒。对每种细菌-碳水化合物组合进行了至少两次独立实验,每次实验使用三个重复。
细菌生长测定为生长曲线下面积(AUC;OD600 x分钟),该数据从Bioscreen C系统获得。
统计分析。
从两次实验中的三次重复中,为每种微生物和碳水化合物组合获得了总共六个重复。所有六个重复被视为一个合并样本,因为在比较重复平均值时未观察到两次实验之间存在系统性差异(学生t检验p值=0.211)。使用多重学生t检验进行碳源之间的成对比较,并使用Benjamini-Hochberg方法校正错误发现率(FDR)。FDR和p值的显著性水平均设定为0.05。热图中的层次聚类使用欧几里得距离和完全连接方法实现。主成分得分使用k均值方法进行聚类。使用R版本3.6.3进行分析。
结果与讨论
GOS的纯化。
为了评估不同细菌菌株对商业GOS产品的利用情况,并了解有多少发酵是由于单糖和二糖的存在引起的,我们纯化了商业GOS产品以降低可利用的单糖和二糖的比例。在人体中,单糖和二糖主要在小肠被吸收,不会到达结肠,而大部分细菌发酵发生在结肠。因此,从商业GOS产品中去除单糖和二糖使我们能够研究一个更类似于到达结肠的未消化较长碳水化合物分子的GOS样品。商业Bimuno GOS粉末(GOS-c)和纯化GOS溶液(GOS-p)的组成见表3。纯化后,聚合度≥3的寡糖比例从58.8面积%增加到92.4面积%,而单糖和二糖含量从41.2面积%减少到7.7面积%。这一纯化步骤使得能够使用富含寡糖且单糖和二糖较少的GOS来评估细菌生长。
细菌生长特性。
HMOs对婴儿肠道微生物群的发育很重要。将HMOs的利用与已知的益生元GOS进行了比较,后者以其商业配方和纯化形式(其中单糖和二糖的比例降低)进行了测试。此外,我们研究了岩藻糖和乳糖的影响,它们是HMOs 2'-FL、3-FL和DFL的组成部分。
为了评估结果,我们将细菌分组如下:(1)双歧杆菌,(2)乳杆菌科,(3)其他人类共生菌,和(4)潜在致病菌。每种细菌的生长培养基见表2。各种碳源(包括未添加碳水化合物的生长培养基)下的细菌生长以热图形式显示在图1中。细菌生长曲线的示例如支持信息图S1所示。与添加的碳水化合物无关的培养基成分相关的生长量在所有双歧杆菌菌株中相似。对于乳杆菌科在MRS-中的生长,观察到比双歧杆菌在各自培养基中的生长略有更多变化。多形拟杆菌(Bthe_TS)和梭菌菌株(Cdif_TS和Cper_TS)的模式菌株分别在PYG-和改良RCM-中单独生长,而沙门氏菌属、志贺氏菌属和大肠杆菌在TSB-培养基中仅经历轻微生长。
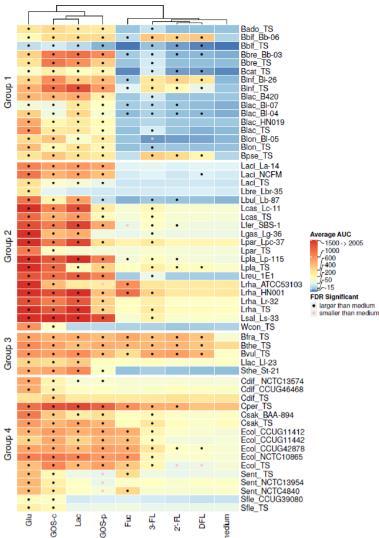
图1. 使用不同碳源及未添加碳源培养基的细菌生长情况。细菌生长通过生长曲线下面积(AUC)进行测量,培养基分别含有1%葡萄糖(Glu)、商业低聚半乳糖(GOS-c)、乳糖(Lac)、纯化富集低聚糖GOS(GOS-p)、岩藻糖(Fuc)、3-岩藻糖基乳糖(3-FL)、2'-岩藻糖基乳糖(2'-FL)或二岩藻糖基乳糖(DFL)。菌株按(1)双歧杆菌属(2)乳杆菌科(3)其他人类共生菌(4)潜在致病菌进行分组,各组内菌株按缩写字母顺序排列(缩写列表参见表2)。AUC值采用颜色编码:深红色>AUC>1500;橙红色AUC 1000-1500;橙色AUC 600-999;浅橙色AUC 400-599;黄色AUC 200-399;浅蓝色AUC 50-199;深蓝色AUC 15-49,便于培养基与碳源之间的比较。经FDR校正的显著性t检验结果(与对应培养基相比)通过对应AUC单元格内的圆点标示。
相关新闻推荐
2、链球菌、金黄色葡萄球菌、大肠杆菌对中性粒细胞活化能力的差异(一)
3、基于β-半乳糖苷酶Lac Z的UPR响应指示菌株的构建及生长曲线测定——摘要
