结果
嗜麦芽窄食单胞菌编码具有多种结构域组成的组氨酸激酶。由于嗜麦芽窄食单胞菌ATCC 13637的完整基因组尚未测序,本研究使用嗜麦芽窄食单胞菌K279a基因组作为参考基因组。根据原核双组分系统数据库,该基因组包含60个HK基因,其中16个是混合HK类型,每个都包含一个额外的接收器结构域作为磷酸化接受体。独立的数据库搜索还显示Smlt2710是一个HWE HK(一组在假定的N和G1框内分别具有特征性His和Trp-Glu残基的HK组)。此外,Smlt4131含有一个具有保守N、G1和G2框的ATP酶结构域,但缺乏典型的HK H框,表明它是一个退化的HK。Smlt2710和Smlt4131也被纳入分析,因此本研究共检查了嗜麦芽窄食单胞菌的62个推定的HK基因(图1)。
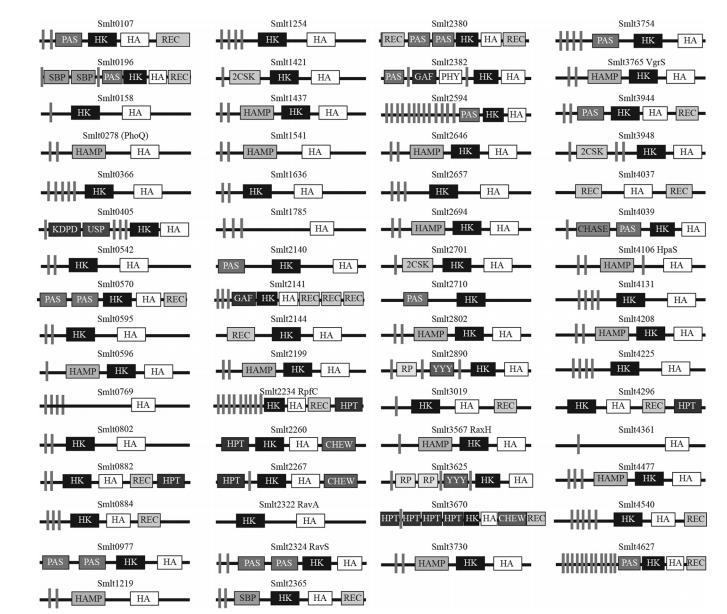
与嗜麦芽窄食单胞菌近缘的黄单胞菌属成员的HK基因比较显示,黄单胞菌属中与毒力相关的HKs的所有直系同源物,包括RpfC(Smlt2234)、VgrS(或ColS,Smlt3765)、PhoQ(Smlt0278)、RavS(Smlt2324)、RavA(Smlt2322)、RaxH(Smlt3567)和HpaS(Smlt4106),也存在于嗜麦芽窄食单胞菌K279a中(图1)。由于嗜麦芽窄食单胞菌不是植物病原体,这些与毒力相关的HKs在两个细菌类群(窄食单胞菌属和黄单胞菌属)之间的信号检测方面可能表现出细微的功能分化。这些HK基因中的大多数(56个基因)在基因组附近至少含有一个RR基因。例外是Smlt0107、Smlt0570、Smlt3019、Smlt3625、Smlt3730和Smlt4540;这六个HKs是孤儿,其同源RRs可能缺失或位于其他基因组位点上。
HK基因的系统插入失活和突变体的表型表征。为了获得嗜麦芽窄食单胞菌ATCC 13637中HK基因的突变体文库,我们最初旨在构建包含HK基因截短DNA序列(300至450 bp)作为插入片段的重组自杀载体(pK18mob)。在嗜麦芽窄食单胞菌K279a基因组中预测为HKs的62个基因中,获得了60个重组载体(见补充材料中的图S1)。两个基因,Smlt1219和Smlt4540,未能通过各种引物进行PCR扩增,表明它们不存在于嗜麦芽窄食单胞菌ATCC 13637基因组中。从这些自杀载体开始,共获得了51个插入突变体,并通过PCR进行了验证(表1)。尽管付出了巨大努力,但11个基因(Smlt1219,Smlt1437,Smlt1541,Smlt2322[ravA],Smlt2382,Smlt2646,Smlt3765[vgrS],Smlt3948,Smlt4131,Smlt4540,和Smlt4627)被证明很难敲除。这些基因在嗜麦芽窄食单胞菌ATCC 13637中可能是必需的,或者它们的失活可能导致在本研究使用的培养条件下严重的生长缺陷。

在丰富NYG平板(1.5%琼脂)和半固体NYG平板(0.1%琼脂)上分别观察了HK基因突变体的菌落形态和游动性(图2),并测量了所有突变体在NYG培养基中的生长曲线(见补充材料中的图S2)。五个基因(Smlt0769,Smlt0882,Smlt0977,Smlt1636,和Smlt1785)的突变体比野生型菌株或其他突变体生长显著缓慢(见补充材料中的图S2)。Smlt0882是肠杆菌荚膜合成中RcsC的直系同源物。RcsC HK调节细菌包膜应激反应,其突变通常影响细胞包膜完整性。Smlt1636在其他细菌中的直系同源物尚未被研究。然而,这两个基因(Smlt0882和Smlt1636)的失活也降低了细菌的游动能力(图2C),这可能是由它们缓慢的生长速率引起的。图2C和补充材料中的表S1显示,除了这两个基因突变体外,还有其他七个突变体也表现出游动能力下降;它们是Smlt1785、Smlt2260(cheA)、Smlt2267(cheA2)、Smlt2324(ravS)、Smlt2380、Smlt2710和Smlt3944突变体。在这些基因产物中,Smlt2260和Smlt2267分别是大肠杆菌生物传感器CheA和CheA2的直系同源物,表明它们参与趋化性调节。Smlt2324(RavS)、Smlt2380、Smlt2710和Smlt3944是含有PAS结构域的HKs,负责检测氧气、氧化还原电位或光,从而表明这些信号对嗜麦芽窄食单胞菌的游动性至关重要。
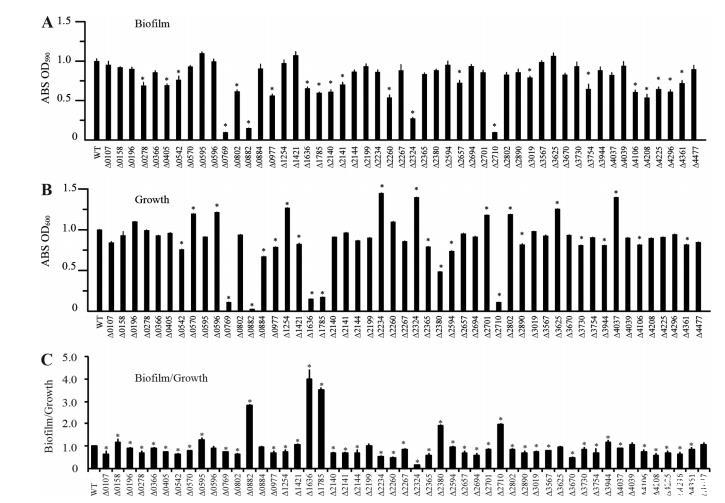
嗜麦芽窄食单胞菌生物膜缺陷突变体的系统筛选。为了研究HK基因突变体的生物膜形成能力,收集在丰富NYG培养基中过夜培养的细菌细胞并洗涤,将各自的浓度调整至OD₆₀₀为0.4。将等体积的细菌培养物(20微升)接种到每个孔含有180微升新鲜NYG培养基的96孔板中。然后将板在28°C孵育5小时,并使用传统的结晶紫染色法计算生物膜量(图3A)。同时,通过测定每种培养物的OD₆₀₀吸光度值来估计孔中的细菌生长(图3B)。为了估计相对于细菌生长的生物膜形成,计算了生物膜量与浮游细菌(OD₆₀₀)的比率(图3C)。结果显示,突变体(ΔSmlt0596,ΔSmlt0884,ΔSmlt3625,和ΔSmlt4477)的生物膜与生长比率与野生型菌株相比没有显著改变。
九个突变体(ΔSmlt0158,ΔSmlt0595,ΔSmlt0882,ΔSmlt1421,ΔSmlt1636,ΔSmlt1785,ΔSmlt2380,ΔSmlt2710,和ΔSmlt3944)的生物膜与生长比率显著增加,而其他38个突变体的比率降低。特别值得注意的是,Smlt4208(命名为BfmK)的插入失活导致生物膜显著减少,这在我们之前使用随机、大规模转座子突变的研究中也观察到。有趣的是,虽然rpfC直系同源物(Smlt2234)的插入失活导致生物膜与生长比率显著降低(图3C),但其不考虑生长的生物膜量并未减少(图3A)。这与黄单胞菌属成员的情况截然不同,后者的rpfC基因突变已被证明会导致细胞间通讯和生物膜形成的明显缺陷。
Smlt4209-Smlt4208是一个控制生物膜形成的TCS。我们接下来专注于进一步研究Smlt4208,因为其突变体稳定地损害了生物膜形成而不影响生长。此外,之前没有研究过该HK基因的其他直系同源物。如图4A所示,Smlt4208位于一个基因组位点,该位点包含一个RR基因(Smlt4209)、一个编码推定的MarR家族转录因子的基因(Smlt4207)和几个功能未知的基因。我们使用不同算法进行的操纵子预测存在争议:ProOpDB预测Smlt4205-Smlt4209形成一个包含五个基因的操纵子,从Smlt4205到Smlt4209,而DOOR数据库的理论预测和MicrobesOnline操纵子预测工具都提出一个仅包含Smlt4208和Smlt4209的操纵子。为了通过实验解读该位点的潜在操纵子结构,设计了一系列引物,并使用RT-PCR检查这些基因之间的基因间转录。RT-PCR分析显示,Smlt4208和Smlt4209确实构成一个双顺反子操纵子,因为我们观察到两个基因之间PCR产物的扩增,这表明它们形成一个转录单元并构成一个完整的TCS(图4B)。然而,该分析未能检测到Smlt4207和Smlt4208之间的转录,表明Smlt4207是基因组中的一个独立转录单位。这一实验结果因此支持了DOOR数据库和MicrobesOnline操纵子预测工具的理论预测。因此,我们将该TCS命名为BfmA(Smlt4209)-BfmK(Smlt4208)。
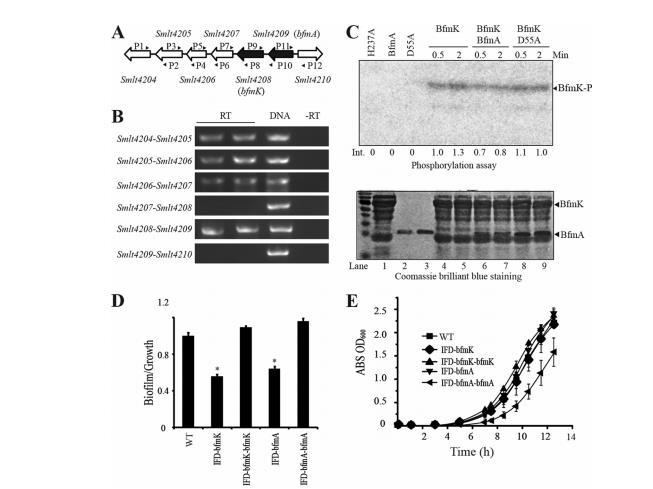
为了验证BfmK和BfmA是否构成一个功能性的TCS,使用pET30a和pET28a分别在大肠杆菌BL21(DE3)细胞中表达全长BfmA和BfmK蛋白。此外,还在对应于BfmA和BfmK蛋白磷酸化位点的遗传密码中创建了点突变,这些修饰的基因用于表达重组BfmA(D55A)和BfmK(H237A)蛋白。可溶性BfmA蛋白(纯度>98%)、BfmK的反向膜囊泡(BfmK比例>20%)及其重组突变体通过Ni-NTA亲和层析成功表达和纯化(图4C)。对重组蛋白进行的体外磷酸化测定显示,全长BfmK反向膜囊泡能够使其保守的His-237位点自动磷酸化,而其重组形式BfmK(H237A)未能被磷酸化(图4C)。这一结果表明BfmK是一个具有自动激酶活性的典型HK。当BfmA被加入反应混合物时,虽然未观察到代表磷酸化BfmA(BfmA-P)的条带,但BfmK-P的磷酸化水平降至对照的约80%。加入BfmA(D55A)蛋白并未降低BfmK-P的水平(图4C)。这一结果表明BfmK可以磷酸化其同源BfmA,但BfmA-P可能不稳定,半衰期太短而无法检测到。
相关新闻推荐
1、不同浓度没食子酸对溶藻弧菌生长、电导率生、物被膜形成、泳动聚集能力的影响(一)
2、豆科作物根瘤菌噬菌体形态结构、生长曲线及生物学特性(一)
3、最佳培养条件下沙福芽胞杆菌生长曲线与CA活性曲线测定及研究(二)
