在ORR污染地下水中,Mn和U浓度高达3 mM和0.6 mM(表1)。一般来说,EC50值对Mn和U较高,七种菌株中的五种对Mn的EC50值>150μM(有些>350μM),七种菌株中的六种对U的EC50值>200μM。例外是Castellaniella菌株MT123,对U的EC50仅6.0μM。该菌株生长最适pH(用于测量EC50值)低于任何其他菌株(表S2)。生长培养基中铀形态随pH剧烈变化,从而影响毒性。
尽管Cr并非所有ORR污染地下水井中的主要污染物(表1),七种菌株对铬酸盐的EC50值范围宽,从7.0μM到>0.5 mM(表3)。再次,Castellaniella菌株MT123有最低的EC50值,可能由于在较低生长pH 5.5下金属毒性增加。在ORR环境中,Cr仅存在于一些测试的污染地下水样品中(FW126、FW106和FW109)(表1),并且除MT123外,所有菌株的EC50值大于ORR地下水中测量的最高Cr浓度。有趣的是,较高的EC50值并不对应该菌株在环境中暴露于Cr。例如,Serratia菌株(MT049)的EC50为0.3 mM(表3),即使它从无检测到Cr的井(GW066)分离(表1)。仅少数反例,每种菌株对三类污染金属之一、二价金属阳离子的EC50值按顺序Ni>Co>Cd>Cu降低(表3)。这通常与污染地下水中这些元素浓度的模式相同。Ni、Co、Cd和Cu的EC50值范围分别为79至160μM、31至120μM、13至157μM和6至66μM。
每种ORR菌株也研究了其对金属离子组合(Cd2+、Cu2+、Fe2+、Co2+、Ni2+、Mn2+和UO22+)的响应。这与富集中使用的COMM相同,除了省略Al以避免沉淀问题。菌株在表3中按对COMM的耐受性排序,EC50值范围从0.9到0.2倍COMM富集浓度。对COMM最敏感的菌株是Castellaniella菌株MT123(EC50 0.24x),它也对Co、U、Cr(不存在于COMM中)和亚硝酸盐有最低EC50值(表3)。有趣的是,Pantoea sp.菌株MT058,它是两种从未污染来源分离的菌株之一,并且是唯一从沉积物分离的菌株(其他六种来自地下水),对COMM有第二高EC50值(0.7x)。
显然,菌株分离来源的地下水的性质并不是它们金属耐受性的良好指标。例如,两种Paenibacillus sp.菌株,MT086和MT124,都从最严重污染井(FW126)分离,但对COMM的EC50值非常不同(0.3x对0.9x)。这一结果也得到它们对单个金属耐受性的支持,其中MT124显示比MT086更耐受Cr、Cd、Cu、Ni和Mn(表3)。奇怪的是MT124高度耐受这些金属阳离子,因为它在U(200μM)存在下富集而非COMM。无论如何,明显七种ORR菌株的金属耐受性性质存在很大变异,并且这与来源地下水无关。
多种金属对硝酸盐还原速率的影响。
一个关键问题是反映ORR污染环境的金属混合物是否影响任何ORR菌株还原硝酸盐的能力。七种ORR菌株在存在和不存在COMM下生长于反硝化条件下,使用支持每种菌株在硝酸盐存在下生长增加的碳源。细胞被收获,并通过亚硝酸盐的产生或消失测量全细胞硝酸盐和亚硝酸盐还原酶水平。如图3所示,七种菌株的特定硝酸盐还原活性(在无COMM下)有60倍变异。值范围从5.4±0.7单位/OD660对于MT124到305±32单位/OD660对于MT086,两者都是Paenibacillus菌株。硝酸盐还原速率和硝酸盐耐受性之间似乎没有关系(表3和图3)。当ORR菌株在COMM存在下生长时,七种中的六种有与无COMM下测量相似的硝酸盐还原酶活性(图3)。

只有Castellaniella sp.菌株MT123,对COMM最敏感的菌株(表3),显示显著降低(从6.0±1.3到1.5±0.6单位/OD660)。MT123也是唯一有可检测亚硝酸盐还原酶活性的菌株。所有其他六种菌株缺乏可检测亚硝酸盐还原酶活性,表明这些菌株还原硝酸盐并排泄生成的亚硝酸盐。当在无COMM下生长时,MT123的亚硝酸盐还原酶活性为22.0±12.5单位/OD660,当与金属混合物生长时为38.5±3.6单位/OD660。由于亚硝酸盐生产用于测定硝酸盐还原酶活性,MT123的亚硝酸盐还原酶活性存在可能导致该菌株的硝酸盐还原酶活性被低估。相反,除MT123外,图3中显示的ORR菌株的硝酸盐还原活性可能真实反映它们还原硝酸盐的能力,并且明显菌株间存在巨大变异。更重要的是,这些largely不受高浓度多种金属影响。
对四种革兰氏阳性菌株(MT066、MT086、MT094和MT124)观察到特定硝酸盐还原活性和亚硝酸盐耐受性(高达80 mM)之间的逆线性关系(r2>0.99)。由于这些菌株都没有亚硝酸盐还原酶活性,一种解释是较高硝酸盐还原产生亚硝酸盐速率的菌株tuned在电子供体有限环境中生存,其中硝酸盐和亚硝酸盐竞争高,预计都不会积累。
匹配耐金属菌株到ORR环境。
在先前对ORR环境的调查中,从93个污染和未污染井取地下水样品,并获得V4区域的16S rRNA基因序列数据。我们使用这些数据搜索本文描述的七种ORR菌株的16S rRNA基因序列V4区域的ESV匹配。七种菌株中,两种Paenibacillus菌株(MT086和MT124)在ORR调查中没有ESV匹配,但其他五种有。然而,这五种ESV的丰度变异很大。例如,Bacillus菌株MT066的ESV仅在93个井中的一个发现,而Castellaniella菌株MT123的ESV存在于32个不同井中,是调查中第177最常见的ESV(表4)。特别是,MT123构成井FW104中ESV读数的7%,这是一个靠近S-3池塘的高度污染井,MT123从中分离。
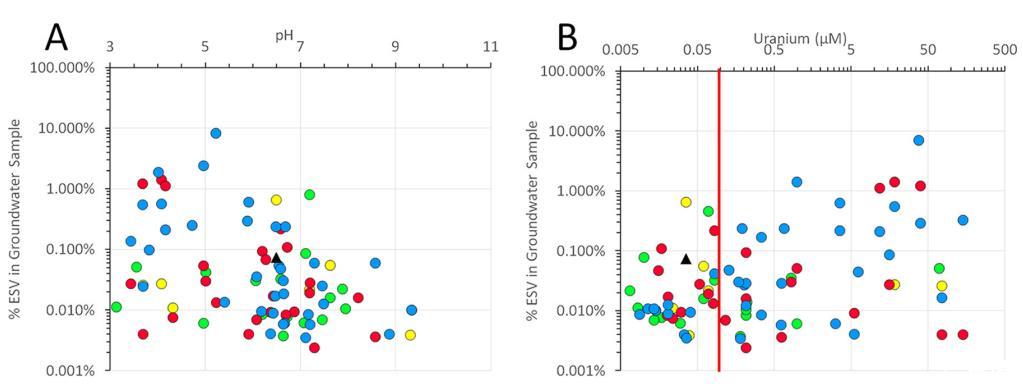
如图4所示,所有五种ORR菌株的ESV匹配发现在井中跨越宽范围pH值(从3.1到10.4)(图4A)和铀浓度(0.007到143μM)(图4B)。实际上,对于所有在多个井中发现的四种菌株(MT049、MT058、MT094和MT123),每种都在未污染(pH~7.0,U<;0.126μM)和高度污染井(pH<4.0,U>70μM)中发现。
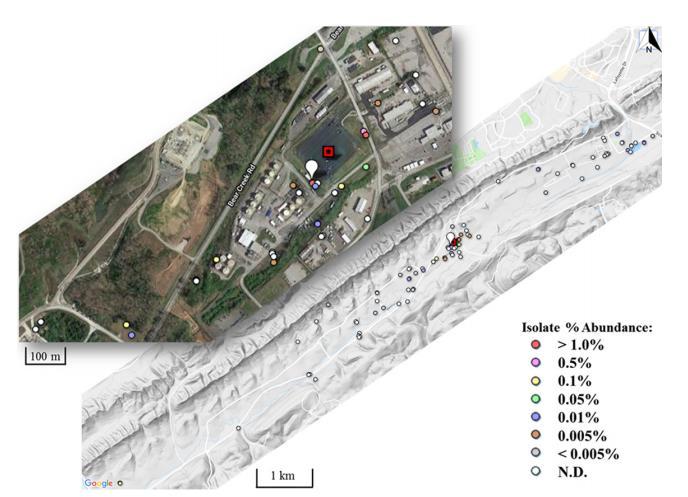
每个井位置的ESV丰度显示用于MT123(图5)、MT049、MT058和MT094。如图5所示,井跨越一个11公里x 1公里区域within Bear Creek Valley包含S-3池塘。分离四种ORR菌株(有ESV数据可用)的井用白色指针标记,S-3池塘用红色方块指示(图5)。
两种菌株从S-3池塘10米内的污染井分离(MT123和MT094),而MT049从未污染井分离,MT058从原始沉积物样品分离,取自S-3池塘7公里外。三种菌株(MT058、MT094和MT123)在它们分离来源的样品中有ESV匹配,另一种(MT049)匹配到一个井(GW537)有0.65%ESV读数,距离分离井不到500米。在地理上,基于ESV数据,所有四种菌株在未污染和污染井中都发现。实际上,从污染井分离的两种菌株(MT094和MT123)都在至少一个原始井中发现,位于站点南部一个无已知污染源的限定点,距离S-3池塘约7公里。所有四种菌株也位于至少一个高度污染井next to the S-3池塘。例如,高度污染井包括FW106、FW109和FW104,所有within 10 m of the S-3池塘。MT049在FW106中占ESV读数的0.026%,MT058在FW106中占0.051%,MT094在FW109中占1.21%,MT123在FW104中占7.0%。通过ESV将分离物位置映射回ORR环境显示,能够在污染环境中生存的菌株并不限于这种专门环境。此外,在环境相关污染条件下富集和分离硝酸盐还原菌株产生耐金属菌株,即使从未污染环境。
相关新闻推荐
2、水稻黄单胞菌噬菌体最佳MOI (A)、一步生长曲线、耐受性测定及基因组分析(一)
