评估抗真菌化合物PTS对黄曲霉的有效性
制备含PTS的培养基
在评估PTS抗真菌化合物时,培养基如上所述制备。水用甘油修改至所需aw水平(0.995和0.95)。完全冷却至室温(25°C)后,在无菌条件下添加适量PTS储备溶液以获得18种不同浓度。之后,培养基使用多通道移液器倒入100孔微孔板。
平行实验在9厘米平皿中进行,使用含2%w/v琼脂的固体琼脂培养基。在这种情况下,为减少实验长度,仅制备九种浓度加对照。当培养基约40°C时,添加适量PTS储备溶液。熔融培养基剧烈摇动后倒入9厘米平皿。
在两种情况下,通过添加适当体积的80%乙醇(EtOH)水溶液(v/v)进行对照实验,含所有PTS加标培养基,给出培养基中最终EtOH浓度0.5%(v/v)。
实验技术和数据收集
制备不同aw水平的半固体YES培养基(0.125%琼脂)储备。完全冷却后,20毫升培养基无菌转移至无菌螺旋盖塑料容器。添加先前制备的不同PTS在80%乙醇水溶液工作标准适量至每个塑料容器,以获得18种不同浓度范围5至100 ppm,内容物摇动。
含PTS的培养基接种200μl含1x10^5孢子/毫升的黄曲霉孢子悬浮液。混合物摇动后倒入无菌平皿,然后使用多通道移液器转移至100孔板。每孔加载300μl,每种浓度使用五个重复孔。不含接种物但含目标乙醇量的培养基作为空白,一旦接种后用作对照。板加载到Bioscreen C中,培养7天,O.D.在600纳米自动每20分钟记录。
使用原始数据生成O.D./时间图,使用Microsoft®Excel®和Sigma Plot v.10.0(Systat Software Inc.,豪恩斯洛,伦敦,英国)。
MIC、NIC和MIC50%(MIC50)计算
LPM(Lambert&Pearson,2000)(方程(1))使用非线性回归拟合,最小化平方和作为搜索标准。分析使用JMP统计软件包(SAS Institute,卡里,NC,美国)进行。MIC和NIC分别使用方程(2)和(3)计算。MIC50使用方程(4)计算。该方程通过解浓度(x)在方程(1)中当P0=(P0/2)时获得。
该值的优势在于它考虑了剂量响应(斜率参数),而其他仅基于MIC的测量则没有。
使用菌丝菌落延伸计算LD50和LD90
使用含1.0x10^6孢子/毫升的孢子悬浮液在0.05%Tween 80盐溶液中,在无菌条件下接种平皿中心。菌丝延伸速率测量超过7天。生长滞后期视为达到5毫米直径菌落的时间(天)。每种处理制备五个平皿,菌落直径在培养期间在两个垂直方向测量。两个直径之和除以4获得半径。这些半径测量然后平均超过使用的重复数。使用Baranyi生长模型(Baranyi等人,1993;Baranyi&Roberts,1994)分析数据,最小化滞后期(λ,小时)和最大比生长速率(μm,毫米/天)计算的主观性。计算LD50和LD90值以比较生长速率与对照处理。
结果
培养基琼脂含量优化
当使用固体培养基(0.5-2%琼脂w/v)时,表面接种和针接种孢子悬浮液到培养基中导致真菌生长。然而,从Bioscreen获得的O.D.时间^-1曲线给出高变异性。重复孔之间和不同重复实验之间的变异性高(数据未显示)。液体培养基提供良好生长产量和较少变异性,但重复孔和重复实验之间仍有显著差异。
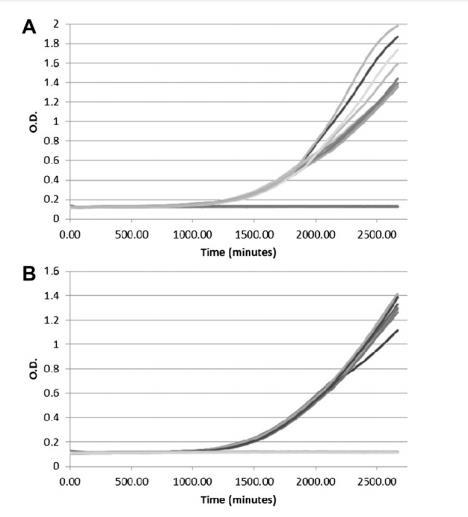
最佳结果使用半固体培养基获得。使用的琼脂含量范围从0.1%到0.2%琼脂w/v。图2显示在YES培养基中含0.125%和0.2%琼脂w/v的十个重复孔生长黄曲霉菌落从孢子接种物的结果。这表明当使用较低琼脂浓度时,孔间重现性更好。因此,选择0.125%w/v琼脂作为最佳选项。不同日期的重复实验给出可重现和一致的结果。
接种物大小优化
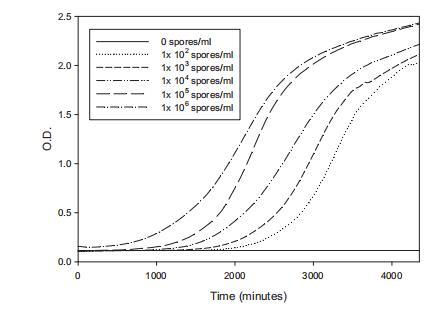
图3显示在YES培养基中接种不同孢子浓度(10^2-10^6孢子/毫升)后获得的平均O.D./时间曲线(十个个体曲线)。为研究重复间变异性,获得曲线平均的均方根误差(RMSE)。结果表明较低孢子负载导致较高曲线分散(RMSE;1x10^2孢子/毫升=0.357;1x10^3孢子/毫升=0.286),而当使用较高浓度时分散较小(RMSE;1x10^5孢子/毫升=0.118;1x10^6孢子/毫升=0.151)。非常高浓度孢子产生初始O.D.轻微增加。基于这些结果,选择最终接种物1x10^5孢子/毫升用于所有后续实验。
孔体积优化
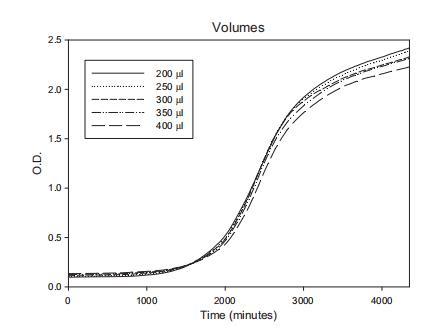
检查不同体积YES培养基含10^5孢子/毫升黄曲霉以确定最佳使用体积。鉴于最大孔体积为500μl,测试体积为200、250、300、350和400μl。平均生长曲线(每种处理十个重复)显示尽管使用最高体积是最低量的两倍,曲线非常相似(图4)。此外,不同平均曲线RMSE值之间未发现差异,范围从0.097到0.132。
不同O.D.值下真菌生物量比较
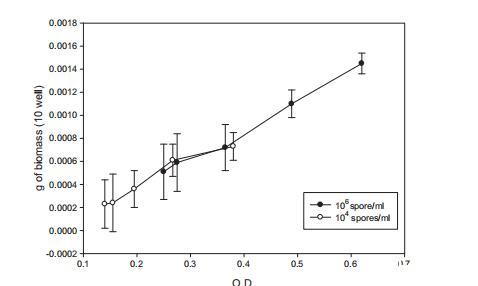
微孔板含50孔加载400μl YES接种1x10^6和1x10^4孢子/毫升黄曲霉,培养后每小时后计算生物量,初始培养13小时后。两种浓度生物量对O.D.读数结果如图5所示。通常,生物量随O.D.增加而增加。当两种初始浓度达到相似O.D.读数时,获得的生物量几乎相同,表明O.D.和生物量之间直接关系。
不同环境条件下PTS效果
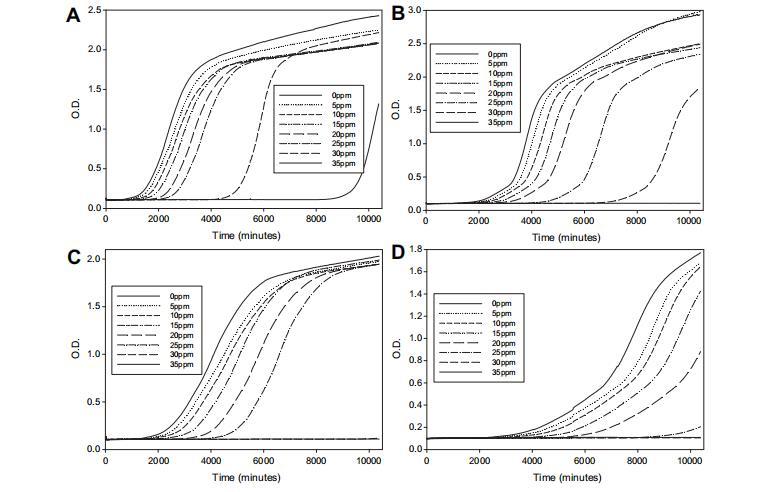
在不同环境条件下,使用八种不同浓度PTS获得的平均生长曲线如图6所示。使用Microsoft®Excel®模板获得所有环境条件下O.D.为0.2的TTD,该模板使用连续O.D.读数之间的线性插值预测O.D.=0.2时的TTD。这些数据使用LPM(方程(1))分析。计算模型参数和95%置信区间。获得值如表1所示。
尽管观察到Po值差异(表明不同环境对在没有抑制剂情况下达到O.D.=0.2所需时间的影响),参数P1和P2在统计上无差异(P>0.05)。这表明尽管获得的菌丝量不同(20°C vs 25°C和aw 0.995 vs 0.95),PTS的效果在不同条件下保持相同。PTS的效果在此短范围内独立于温度和aw。
MIC、NIC和MIC50计算及与LD50值和视觉观察比较
使用前一节获得的参数,根据方程(2)-(4)计算MIC、NIC和MIC50,及其95%置信限。LD50值通过比较使用Baranyi模型获得的生长速率计算。所有数据比较如表2所示。计算的所有四种环境条件的NIC、MIC和MIC50在统计上无差异(P>0.05)。这些相似性显示PTS的有效性独立于这些环境条件。
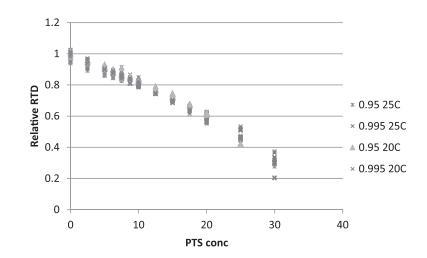
在模型中,Po取决于环境条件,除了PTS。此外,作为环境因素独立性的证明,相对RTD对PTS浓度的表示已绘制(图7)。这显示所有数据落在同一线上,证明真菌行为对相同PTS浓度相似。7天后,MIC值准确预测在YES平皿中50 ppm PTS下未观察到生长。
与LD50值相比,获得的MIC50浓度始终小于使用基于延伸速率的传统方法计算的值。而LD50值,比较菌落生长速率,范围从40到45 ppm,MIC50值,基于比较菌丝生物量,范围从32到34 ppm。部分原因可能在于MIC50使用计算的剂量响应,而LD50计算缺少这一点。
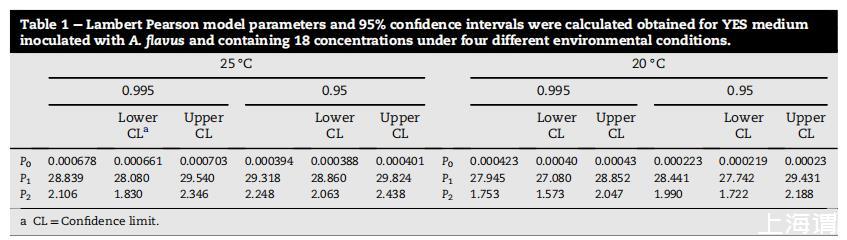
表1:LPM参数和95%置信限。
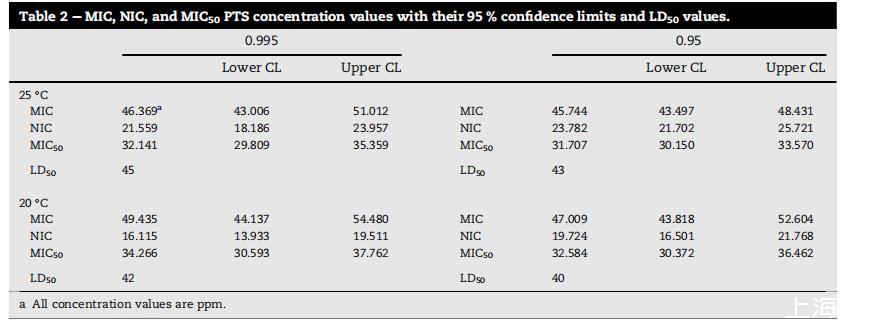
表2:PTS浓度值的MIC、NIC和MIC50及其95%置信限和LD50值。
相关新闻推荐
1、24株II组肉毒梭菌菌株最低和最高生长温度下的生长速率测定(一)
