1.2.4噬菌体形态观察
参考《分子克隆实验指南》中关于噬菌体颗粒的PEG/NaCl沉淀提取法进行噬菌体纯化颗粒制备,噬菌体颗粒溶于SM缓冲液中,4℃保存备用;用负染色法对噬菌体颗粒进行染色,取20μL噬菌体颗粒与20μL浓度为0.5%的戊二醛混合,滴在铜网上静置15 min,使噬菌体颗粒固定。用2%的磷钨酸对噬菌体颗粒进行负染色1-2 min,用滤纸吸干多余液体,用透射电镜在80 kV电压下观察。拍照并储存。
1.2.5噬菌体最佳感染复数(multiplicity of infection,MOI)测定
将培养至对数期,OD600nm≈0.2,菌液浓度约为1×109 CFU/mL的宿主菌液,与已知滴度的噬菌体液(2×109 CFU/mL)倍比稀释,按照噬菌体滴度与宿主菌浓度的比值分别为100、10、1、0.1、0.01、0.001、0.000 1的比例混匀,37℃,160 r/min培养4 h,取出后用0.45μm滤器过滤,滤液倍比稀释后测定各体系下的噬菌体滴度,滴度最高的体系的比值即噬菌体的最佳感染复数,重复3次。
1.2.6噬菌体一步生长曲线及爆发量测定
取最佳MOI对应的宿主菌液和噬菌体液各500μL,放入培养箱,37℃培养10 min,将混合液8 000 r/min离心30 s,吸弃上清液,然后加入1 mL NB吹打使沉淀重悬,重复两次。在锥形瓶中加入此悬液,再加19 mL营养肉汤,放入摇床,37℃,160 r/min,开始每5 min取样1 mL,30 min后,每10 min取样1 mL,至100 min停止取样。每次取样都需用0.45μm滤器过滤,然后暂时放入4℃保存,待全部取样完成后,统一取出进行倍比稀释,测定噬菌体滴度,重复3次。
1.2.7噬菌体的热稳定性和pH稳定性试验
(1)噬菌体热稳定性。将噬菌体液分成4组,每组6 mL,分别放入50℃、60℃、70℃、80℃的水浴中,每隔10 min取1 mL噬菌体液稀释10倍,防止高温影响实验结果,暂时放入4℃保存,待全部取样完成后,统一取出进行倍比稀释,测定噬菌体滴度,重复3次。
(2)噬菌体pH稳定性。取1 mL的噬菌体液加入9 mL不同pH(1-14)的营养肉汤中,37℃恒温培养1 h,取出后进行倍比稀释,用上文的方法测定噬菌体滴度,重复3次。
1.2.8噬菌体宿主范围测定
将实验室保存的其他大肠埃希菌、蜡样芽孢杆菌、金黄色葡萄球菌全部复苏并培养至对数期,取500μL菌液加入小试管中,再加入5 mL半固体培养基(50℃左右),混匀后使半固体培养基平铺在琼脂平板上,凝固后在中心处滴加2-3滴噬菌体液,晾干后37℃倒置培养过夜。次日观察各个平板中心是否出现噬菌斑。
1.2.9噬菌体DK-13全基因组测序及分析
按1.2.4方法获得的500μL噬菌体浓缩液,加入2.5μL DNase I(1 mg/mL)和0.5μL RNase A(1 mg/mL),之后加入25μL EDTA,25μL蛋白酶K和20μL SDS,56℃水浴1 h,裂解噬菌体。随后使用苯酚-氯仿-异戊醇(25∶24∶1)提取噬菌体DNA,送至杭州联川生物技术股份有限公司进行全基因组测序。使用在线软件tRNAscan-SE预测噬菌体中是否含有tRNA;CG view展示序列中GC skew-和GC skew+等特性情况的圆形基因图。
使用ORFs Finder预测噬菌体DK-13的开放阅读框(ORF);使用BLAST(Basic Local Alignment Search Tool)预测并注释每个开放阅读框的功能;使用VFDB(Virulence Factors of Pathogenic Bacteria)数据预测噬菌体DK-13是否含有毒力基因;使用CARD(The Comprehensive Antibiotic Resistance Database)数据库检索预测噬菌体DK-13是否含有耐药基因。
选取噬菌体DK-13的保守基因DNA连接酶进行BLASTP(http://www.ncbi.nlm.nih.gov/BLAST/),寻找同源性蛋白,再使用MEGA6(https://www.megasoftware.net/)软件邻域连接构建噬菌体DNA连接酶的系统发育进化树进行进化关系分析。
1.2.10细菌污染猪肉模型制备及不同温度下噬菌体DK-13对污染猪肉的杀菌效果
将从超市购买的猪里脊肉部分用无菌刀片切成边长约为2 cm的正方形薄片,用1 mL PBS缓冲液冲洗,紫外灭菌2 h,使肉片充分灭菌。滴加100μL浓度为1×107 CFU/mL的宿主菌液滴在肉片表面,使其充分接触,静置10 min,得到浓度为1×106 CFU/sample的EIEC污染的猪肉样品,放入4℃冰箱保存。
取最佳感染复数的宿主菌液的噬菌体液滴在猪肉样品表面,使其与样品充分接触进行杀菌,对照组则滴加等体积的PBS缓冲液,分别放入4℃冰箱和37℃恒温培养箱培养6 h。每隔1 h取样一次,加入装有PBS缓冲液的离心管中,充分震荡后在相应温度下,5 000 r/min离心1 min,吸弃上清后再加1 mL PBS缓冲液,重悬后在相应温度下5 000 r/min离心1 min,重复两次。将最后一次悬液梯度稀释,取100μL菌液均匀涂布在平板上,37℃倒置培养过夜。次日对平板上菌落进行计数。重复3次。
2结果
2.1噬菌体的分离及其滴度测定
从医院未经处理的污水中分离出了一株烈性噬菌体,命名为DK-13,采用双层平板法纯化后,得到了纯化后的单一噬菌体,噬菌体DK-13的噬菌斑为圆形,透明且无晕环,直径约为1-2 mm。结果如图1-A所示。
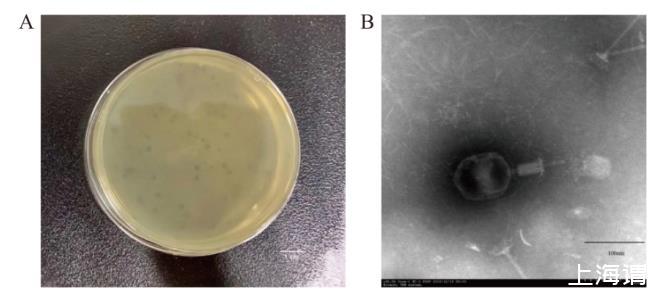
图1噬菌体DK-13的形态特征
A:噬菌体形态;B:透射电镜形态
通过计算可以得出噬菌体DK-13的滴度约为2×109 PFU/mL。
2.2噬菌体形态学观察
如图1-B所示,噬菌体DK-13呈典型的蝌蚪状外形,包含一个直径约为100 nm的正二十面体的头部和一个可收缩的螺旋对称的尾部,根据ICTVdb数据库的规则分类,噬菌体DK-13属于有尾噬菌体目(Caudovirales)肌尾噬菌体科(Myoviridae)T4噬菌体亚科(Tevenvirinae)噬菌体。
2.3噬菌体最佳感染复数的测定
噬菌体DK-13与宿主菌EIEC的感染复数为0.01时,产生子代噬菌体的数量最多,效价为2.8×1010 PFU/mL,说明噬菌体DK-13的最佳感染复数为0.01(图2-A)。
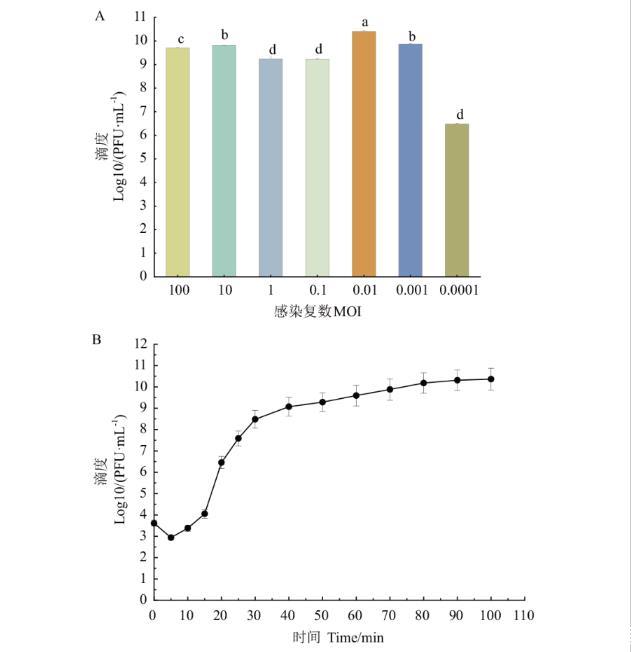
图2噬菌体DK-13的生物学特性
A:噬菌体DK-13的MOI;B:噬菌体DK-13的一步生长曲线。不同小写字母表示处理组别间有显著差异(P<0.05)。下同
2.4噬菌体一步生长曲线及爆发量的测定
取最佳感染复数0.01对应的宿主菌液和噬菌体液各500μL,测定不同时间噬菌体的滴度。以时间为横轴,噬菌体滴度的对数为纵轴,绘制一部生长曲线。结果如图2-B所示,噬菌体DK-13的潜伏期约为10 min,裂解期约为70 min,平均爆发量为164 PFU/cell。
2.5噬菌体稳定性的测定
2.5.1噬菌体在不同温度下的稳定性
本试验测试了噬菌体DK-13在50℃、60℃、70℃和80℃的条件下,1 h之内的活性情况。结果如图3-A所示,在50℃和60℃时,噬菌体的活性几乎不发生变化;70℃下噬菌体活性下降,20 min后完全失活;温度升高至80℃,噬菌体10 min后完全失活。结果表明噬菌体DK-13受温度影响较小。
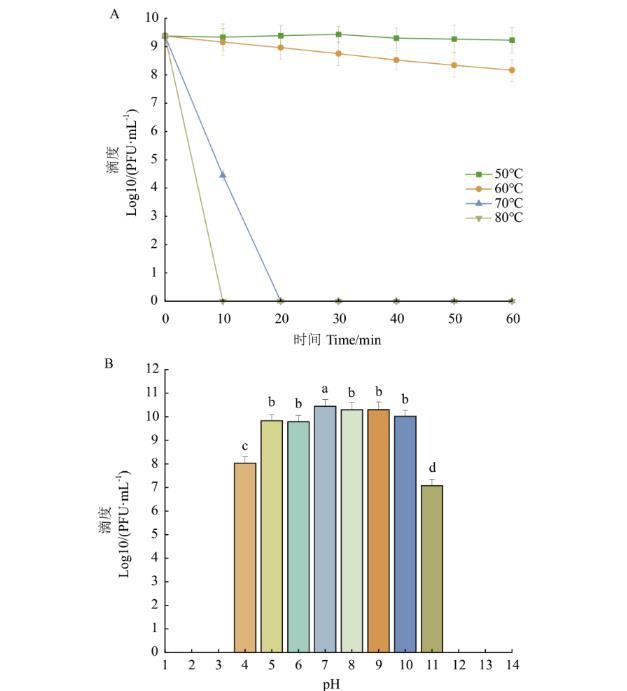
图3噬菌体DK-13的生物学特性
A:噬菌体DK-13的热稳定性;B:噬菌体DK-13的酸碱稳定性
2.5.2噬菌体在不同pH下的稳定性
噬菌体DK-13在pH 1-14的环境下,1 h之内的存活情况测试结果如图3-B所示:在pH 5-10的条件下,对噬菌体DK-13的活性并没有很大的影响,噬菌体均体现了较高的活性;在pH 4或pH 11的条件下,噬菌体的活性略有下降,但依然有大量噬菌体存活;在pH<4或pH>11的条件下,几乎检测不到存活的噬菌体。
2.6噬菌体宿主范围的测定
将实验室保存的其他15株大肠埃希菌,2株蜡样芽孢杆菌,3株金黄色葡萄球菌全部复苏并培养至对数期,用噬菌体DK-13进行裂解测定,结果显示噬菌体DK-13不能裂解以上任何细菌,只能裂解宿主菌EIEC。说明噬菌体DK-13的特异性非常强。详细结果见表1。
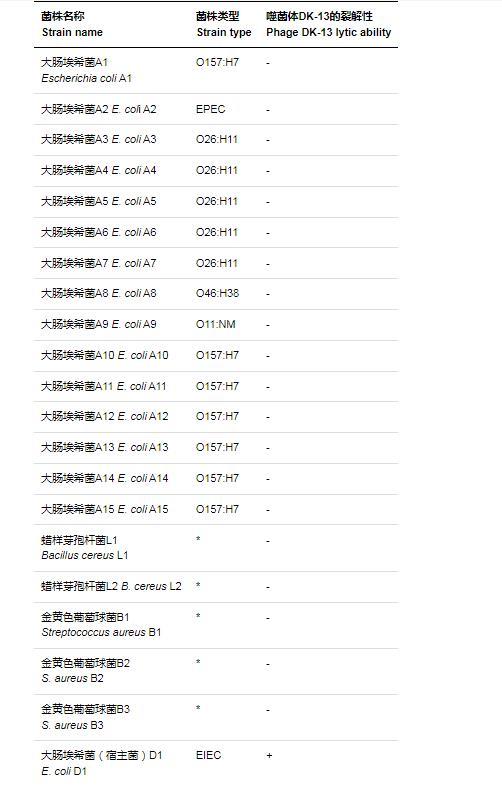
表1噬菌体DK-13宿主范围
2.7噬菌体全基因组分析
测序结果显示:噬菌体DK-13基因组全长172 275 bp,GC含量为40.18%。tRNAscan-SE分析结果显示:噬菌体DK-13基因组中含有tRNAMet、tRNAArg。噬菌体DK-13的全基因组信息已上传至GenBank,登录号为MT611523。
相关新闻推荐
1、乙酸胁迫下酵母细胞絮凝提高酵母的应激耐受性和高效的纤维素乙醇生产
