细菌在生长繁殖过程中,可通过测定细菌的生长量,来了解细菌的各种生理生化状态。目前,细菌生长量的测定主要有4类方法:细胞数目的测量(直接显微计数法、平板活菌技术、载片培养技术、微孔过滤法、库尔特计数器、流动细胞光度法、表荧光滤过技术、荧光抗体技术、微型ELISA、电子显微镜);细胞量的测量(干重法、比浊法、离心压缩细胞体积法);细菌浓度的间接测量(通过测定核酸、蛋白质、多糖、脂质、ATP等含量来估算菌浓度,或通过测量C、N、O和P等元素的含量间接计算菌浓度);生物量在线检测(微热量计法、荧光法、电容/电导/阻抗法等)[1]。其中比浊法检测成本低、快速,而在线检测技术准确,可实时分析细菌生长过程中的生长量,因此具有较好的应用前景。该文以早期分离筛选的泰乐菌素降解菌——无丙二酸柠檬酸杆菌(Citrobacteramalonaticus)为材料[2],比较了活菌稀释计数法、比浊法和电导率法绘制该菌生长曲线的差异,为研究该菌的形态学特征、适应性及泰乐菌素降解机理提供其生长量参数。
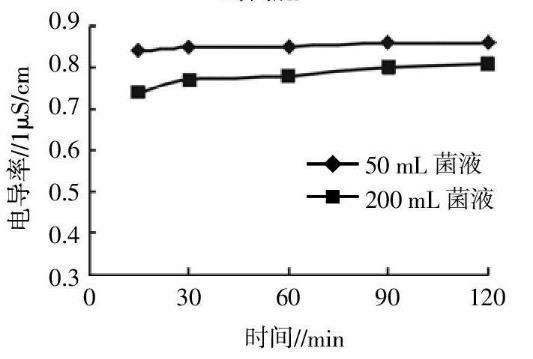
生长曲线的测定取48h培养后的泰乐菌素降解菌种子液,将种子液按10%的接种量培养,分别在8~72h中,间隔8h取样。用活菌计数法测量培养基中细菌浓度,同时以121℃,灭菌20min的YPD培养基为对照,采用比浊法测定菌液浓度,重复3次,计算平均值;分别在8~72h间,每间隔4h取菌液1mL,加入装有30mL去离子水的试管中,同上条件超声处理,取细胞破碎后的菌液5.0mL,用DD-12A型电导率仪测定电导率值,每个样品测定3次,计算平均值。绘制泰乐菌素降解菌培养时间与In(cfu/mL)以及OD500nm和电导率值的生长曲线。
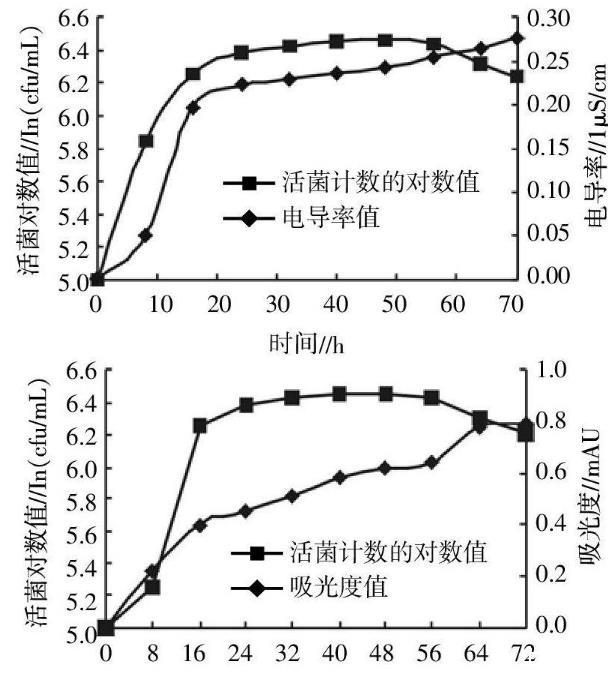
泰乐菌素降解菌的生长曲线
分别采用活菌稀释计数法、电导率法和比浊法对泰乐菌素降解菌的生长曲线进行测定,结果如图1,图2所示。活菌稀释计数法测定的降解菌生长曲线符合细菌生长的各个阶段:0~8h为降解菌生长的延迟期,8~24h为对数生长期,24~56h为稳定期,56~72h为衰亡期。电导率法测定的生长曲线也有明显的延迟期、对数生长期和稳定期,且延迟期和对数生长期的时间范围和活菌稀释计数法相似,但此法所测到的稳定期为24~72h,无衰亡期。而分光光度法的生长曲线始终保持上升状态,无明显的延迟期、对数生长期、稳定期和衰亡期。
相关新闻推荐
1、高产蛋白酶乳酸杆菌高效筛选方法、生长曲线测定及耐受能力分析(二)
2、斜带石斑鱼哈维氏弧菌分离纯化、生长曲线绘制及耐药性研究(一)