2.3 SLM对PEDV增殖的抑制作用
如图3A所示,为PEDV感染和SLM作用示意图,为了进一步确认SLM对PEDV增殖的影响,使用RT-qPCR、病毒滴度测定、Western blot、IFA多种技术进行检测。Western blot和RT-qPCR结果显示,与PEDV感染组相比,SLM能够显著降低PEDV N蛋白和N基因的表达和转录(P<0.01)
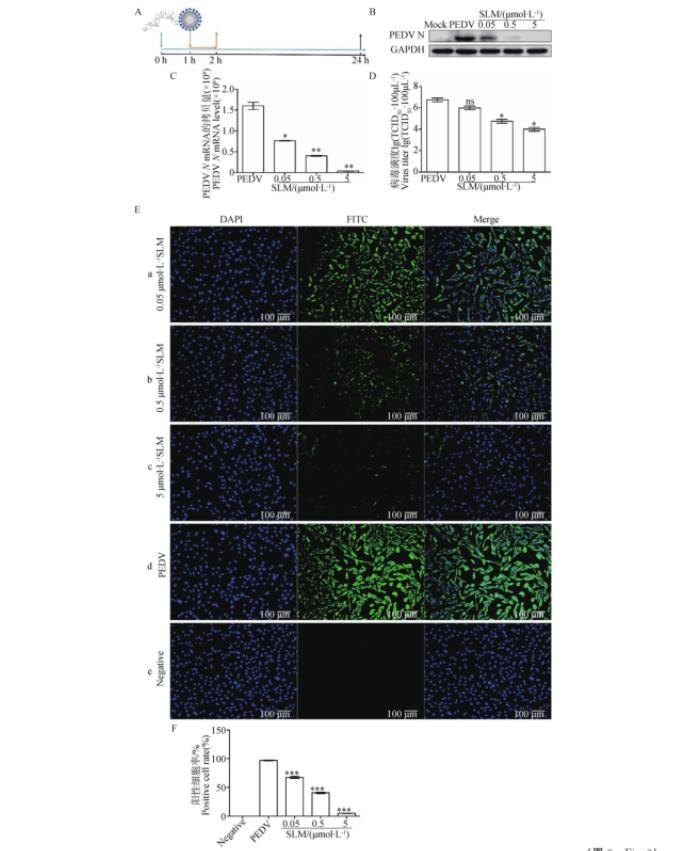
(图3B和C)。病毒滴度的结果显示,与PEDV感染组相比,SLM可以显著降低病毒含量(P<0.01)(图3D)。IFA的结果表明,PEDV感染组的绿色阳性细胞最多,而随着SLM含量的增加,阳性细胞逐渐减少(图3E);与PEDV感染组相比,不同浓度SLM(0.05、0.5、5μmol·L-1)处理组的阳性细胞率均显著降低,且差异极显著(P<0.001)(图3F)。
2.4 SLM对PEDV复制周期的影响
2.4.1 SLM不能直接作用于PEDV SLM和PEDV直接作用的方式如图4A所示,RT-qPCR测定各组的核酸含量并进行统计学分析,结果如图4B所示,分别比较SLM与PEDV作用不同时间段后的结果,SLM处理组与PEDV感染组的病毒mRNA水平在统计学上差异不显著(P>0.05),表明SLM不能直接作用于PEDV。
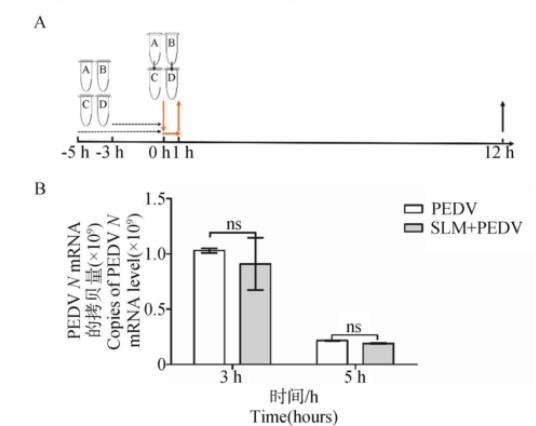
A.病毒感染和药物作用示意图;B.RT-qPCR检测PEDV感染和SLM处理后N基因水平
图4 SLM对PEDV病毒粒子的影响
2.4.2 SLM不影响PEDV吸附SLM作用于PEDV吸附阶段的过程如图5A所示,在病毒吸附的同时加入SLM,孵育相应的时间后SLM处理组与PEDV感染组相比,PEDVN基因mRNA水平没有显著差异(P>0.05)(图5B),表明SLM对PEDV的吸附没有显著影响。
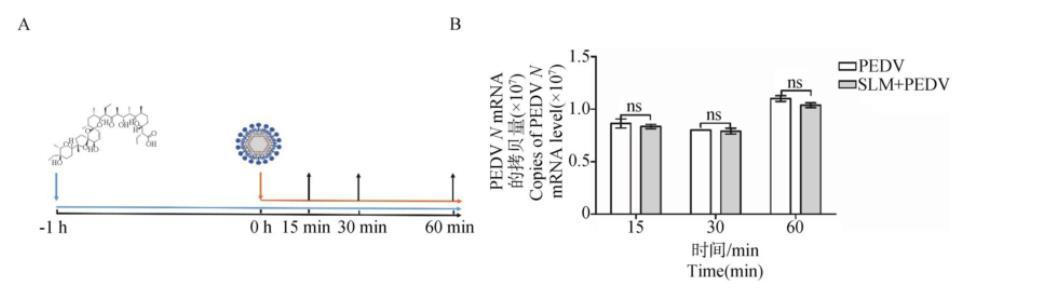
A.病毒感染和药物作用示意图;B.RT-qPCR检测PEDV吸附阶段加入SLM后PEDV N基因水平
图5 SLM对PEDV吸附Vero细胞的影响
2.4.3 SLM不影响PEDV入胞如图6A所示,在PEDV入侵细胞阶段加入SLM,孵育相应的时间后SLM处理组与PEDV感染组相比,细胞内PEDVN基因mRNA水平无显著差异(P>0.05)(图6B),表明SLM对PEDV的入胞没有显著影响。
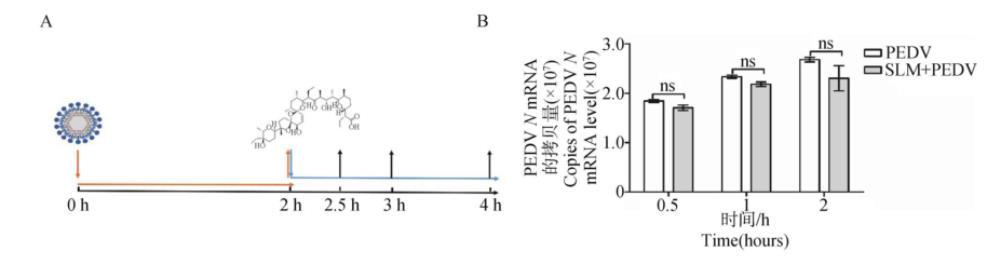
A.病毒感染和药物作用示意图;B.RT-qPCR检测PEDV入胞阶段加入SLM后PEDV N基因水平
图6 SLM对PEDV入侵Vero细胞的影响
2.4.4 SLM抑制PEDV复制阶段SLM作用于PEDV复制阶段的过程如图7A所示,在病毒复制阶段加入SLM,孵育4或6 h后,SLM处理组与PEDV感染组之间PEDVN基因的mRNA水平差异显著(P<0.05)(图7B),病毒滴度的结果表明在病毒复制阶段加入SLM可以显著降低细胞内病毒粒子的数量(P<0.05)(图7C),以上结果均表明SLM影响PEDV的复制阶段。
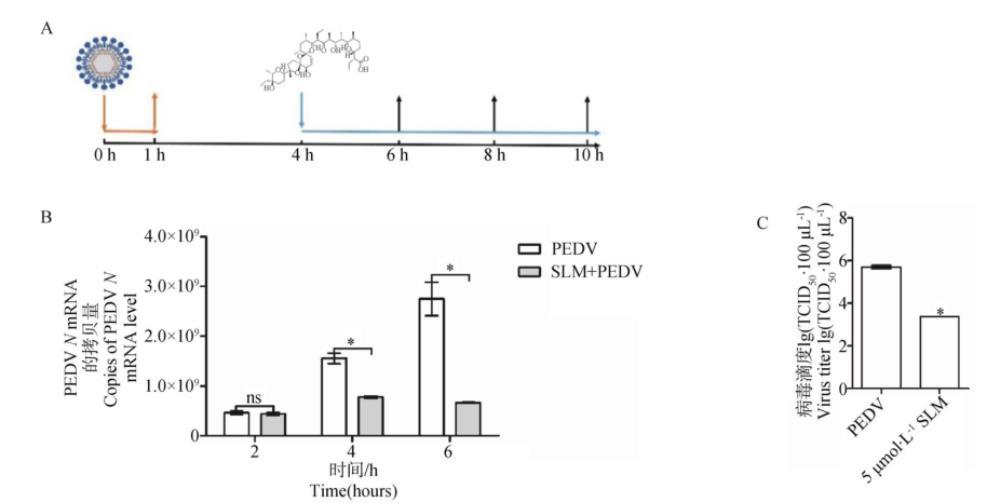
A.病毒感染和药物作用示意图;B.RT-qPCR检测PEDV复制阶段加入SLM后PEDV N基因水平;C.病毒粒子释放水平
图7 SLM对PEDV在Vero细胞中复制的影响
2.4.5 SLM不影响PEDV释放如图8A所示,在PEDV释放阶段加入SLM,孵育相应时间后SLM处理组与PEDV感染组之间的病毒含量没有显著差异(P>0.05)(图8B),表明SLM对PEDV的释放没有显著影响。
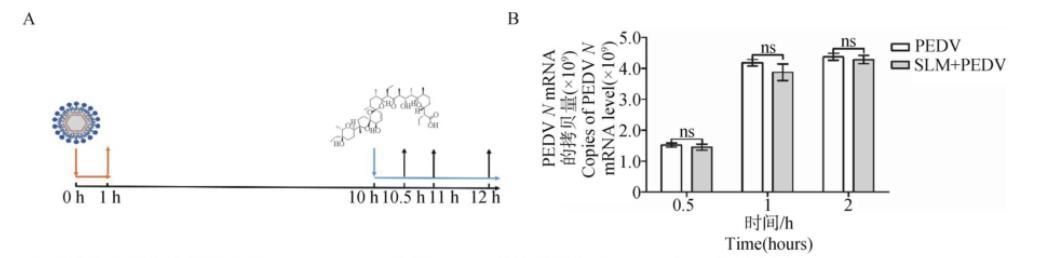
A.病毒感染和药物作用示意图;B.RT-qPCR检测PEDV释放阶段加入SLM后N基因水平
图8 SLM对PEDV从Vero细胞释放的影响
