1.10 SLM对PEDV复制周期的影响
1.10.1 SLM对病毒粒子的作用将Vero细胞接种于12孔细胞培养板,待细胞长到90%后,将以下四管溶液(A:0.2 MOI PEDV和5μmol·L-1SLM混合液,B:0.2 MOI PEDV稀释液,C:维持液,D:5μmol·L-1SLM稀释液)各设置两组,分别放置在培养箱中作用3 h和5 h,将以上溶液接种于Vero细胞,然后置于37℃孵育1 h,用PBS洗涤细胞,再加入维持液继续培养12 h,然后收集病毒液,提取核酸,RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的高低,判断SLM是否对PEDV病毒粒子具有直接灭活作用。
1.10.2 SLM对病毒吸附的影响将Vero细胞接种到12孔细胞培养板,待细胞长到90%后,用含有0或5μmol·L-1SLM的维持液在37℃预处理细胞1 h,然后用含有0.2 MOI PEDV和相应SLM浓度的混合液在4℃处理细胞15、30和60 min,再用冰冷的PBS洗涤后收集细胞,提取核酸,使用RT-qPCR检测细胞中PEDVN基因的mRNA水平。通过比较同一时间段SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响病毒的吸附。
1.10.3 SLM对病毒入胞的影响将Vero细胞接种到12孔细胞培养板,待细胞长到90%后,首先将细胞板放入4℃预冷,然后用0.2 MOI PEDV在4℃感染细胞2 h,再更换含有0或5μmol·L-1SLM的维持液,37℃继续孵育0.5、1和2 h,用预冷的PBS洗涤细胞,以去除未入胞的病毒,最后收集细胞,提取核酸,使用RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响PEDV的入胞。
1.10.4 SLM对病毒复制的影响将Vero细胞接种于12孔细胞培养板,待细胞长到90%后,将细胞上清液更换为含有0.2 MOI PEDV的维持液,在37℃培养箱中孵育1 h,用PBS洗涤细胞后补充维持液,继续在37℃培养箱中培养,在接毒后4 h将培养基更换为含有0或5μmol·L-1SLM的维持液,置于37℃继续孵育2、4和6 h,然后用PBS洗涤细胞,收集细胞后提取RNA,并反转录成cDNA,RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响病毒的复制。
1.10.5 SLM对病毒释放的影响将Vero细胞接种于12孔细胞培养板中,待细胞长到90%后,用0.2 MOI PEDV在37℃感染细胞1 h,然后更换为维持液继续培养10 h,再将培养基更换为含有0或5μmol·L-1SLM的维持液继续孵育0.5、1和2 h后收集样品,提取核酸,RT-qPCR检测PEDVN基因的mRNA水平。通过比较SLM处理组与PEDV感染组的PEDVN基因mRNA水平的相对高低,判断SLM是否影响PEDV的释放。
1.11统计学分析
所有试验至少重复3次,使用SPSS 26软件对数据进行统计分析,并使用GraphPad Prism 5.0软件作图,结果表示为平均值±标准偏差。使用单因素方差分析(ANOVA)检查组间差异的统计显著性。图中星号表示有显著差异(*.P<0.05表示差异显著;**.P<0.01表示差异非常显著;***.P<0.001表示差异极显著;ns代表差异不显著)。
2结果
2.1 PEDV的TCID50及其在Vero细胞上的生长曲线
用Reed-Muench两式法测定PEDV感染Vero细胞不同时间的TCID50,绘制病毒生长曲线,结果如图1所示,PEDV感染细胞后24 h病毒滴度最高,约107.7·0.1 mL-1,随后病毒滴度缓慢下降,感染后60 h的TCID50约107.2·0.1 mL-1。
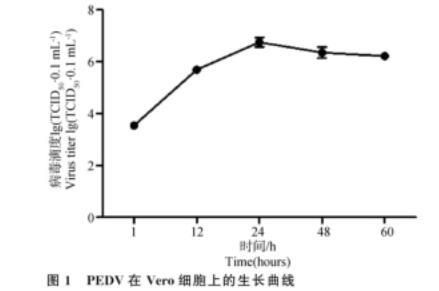
图1 PEDV在Vero细胞上的生长曲线
2.2 CC50和IC50
为了确定后期试验所使用的SLM浓度,首先使用CCK-8试剂盒测定不同SLM浓度下的细胞活力,结果表明SLM的CC50为7.698μmol·L-1(图2A);经统计不同浓度SLM处理组的CPE,结果表明SLM对PEDV的IC50为1.617μmol·L-1(图2B)。同时,经CCK-8试剂盒测定所用SLM浓度(0.05、0.5、5μmol·L-1)处理后的细胞活力,结果如图2C所示,以上浓度的SLM对Vero细胞活力无影响。
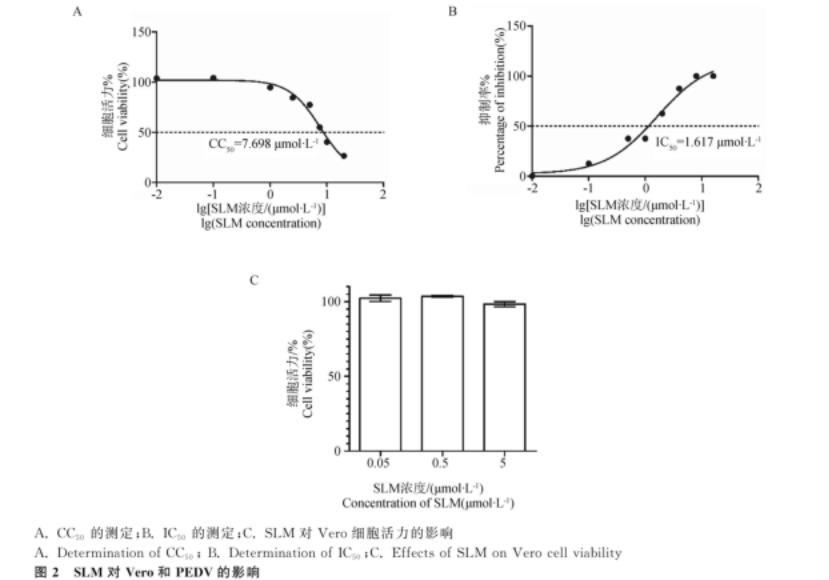
A.CC50的测定;B.IC50的测定;C.SLM对Vero细胞活力的影响
图2 SLM对Vero和PEDV的影响
