摘要
在不同环境条件下(pH 4.5至7,NaCl浓度0.5%至8%,30°C),测定了接种单细胞李斯特无害菌(Listeria innocua)的孔洞产生浊度的时间分布。通过统计分析确定,检测时间T变异性的主要来源是单个细胞延滞时间(lag time)的变异性。检测时间与其标准差之间存在线性关系dev(T)~T。在生长缓慢的条件下,其他变异来源的影响逐渐显著。
1.引言
浊度测量被用作传统平板计数的替代方法,用于估计细菌的生长参数(McMeekin等,1993)。随着预测微生物学的新趋势开始关注细菌对食品环境反应的变异性量化,其应用日益增加。这在微生物风险评估研究中尤为重要。自动化浊度测量系统能够产生大量重复观测数据,这对方差分析计算至关重要。
浊度是入射光强度与培养物散射光强度之比。在较高细胞密度(10.0至10.5 CFU/ml)时,它遵循比尔定律,即浊度与细胞浓度成正比(McMeekin等,1993;Begot等,1996)。比例范围取决于细菌的大小和形状,而这些又受环境条件的影响。例如,单核细胞增生李斯特菌(Listeria monocytogenes)在乳酸存在下具有很窄的线性范围(Le Marc,2002)。细胞浓度与浊度之间的相关性(也称为校准)取决于细菌种类,有时甚至取决于所使用的特定菌株(Begot等,1996)。由于浊度与细胞浓度之间存在可接受关系的范围有限,生长参数的估计常常不准确。
一些作者将光密度(OD)曲线的参数直接与“真实”(活菌计数)比生长速率和延滞时间联系起来(例如Dalgaard等,1994;Begot等,1996;Augustin等,1999;Dalgaard和Koutsoumanis,2001)。他们将生长曲线拟合到OD值,并通过校准使用这些曲线描述细胞浓度的增加。在大多数(但非所有)条件下,结果相当良好(Dalgaard和Koutsoumanis,2001)。作为替代方案,其他作者提出使用观测到的检测时间(即细胞群体达到可检测浊度水平所需的时间),而不是整个浊度生长曲线(Cuppers和Smelt,1993;McClure等,1993;Augustin等,1999;Baranyi和Pin,1999;McKellar和Knight,2000)。将检测时间对初始细胞浓度作图,应得到一条直线,其斜率与比生长速率成反比。该技术用于本研究中对单个细胞延滞时间的群体内方差分析。
传统上,延滞期在“细胞浓度对数-时间”曲线上定义。延滞期结束时间是生长曲线指数期切线与接种物水平相交的时间点。Baranyi和Roberts(1995)提出了一个更机械化的定义。引入了初始生理状态参数(a₀),延滞期计算为a₀及后续比生长速率的函数。
单个细胞的延滞时间与群体延滞期之间的联系并不直接。Baranyi(1998,2002)和Baranyi和Pin(2001)分析了这一点,并推导出一个数学公式,将个体延滞时间的分布与整个群体的延滞期联系起来。该公式意味着,个体延滞时间的平均值可能远长于群体水平观测到的延滞期,尽管个体生理状态参数的平均值与群体的生理状态参数相同。此外,从延滞期到指数期的过渡曲线可以通过个体延滞时间分布的变换获得,但就当前可用数据的精度而言,从群体生长曲线推断个体延滞时间的分布是不可能的。因此,使用传统活菌计数无法研究单个细胞的延滞时间。自动化浊度测量可能提供解决方案,因为它们适合产生大量重复检测时间测量数据。如果每个观测培养物从一个单细胞开始,那么检测时间的分布应接近初始单个细胞延滞时间的分布,假设由单细胞产生的每个群体的比生长速率相同且恒定。
本文通过单细胞生成的亚群体产生的浊度检测时间,确定了李斯特无害菌的个体延滞时间。细胞经受不同pH和NaCl浓度处理,并通过统计方法分析这些环境因素对所得分布的影响。
2.材料与方法
2.1.实验
2.1.1.菌株
使用李斯特无害菌(L.innocua)作为测试生物,因为它操作安全,且具有与食品病原体单核细胞增生李斯特菌(L.monocytogenes)相似的特性,后者是食品工业的主要关注点。李斯特无害菌菌株NCTC 11288,血清型6a,保存在3°C存储的胰蛋白胨大豆琼脂斜面(TSA,Oxoid)上。
2.1.2.生长曲线
将L.innocua从储备斜面传代培养至胰蛋白胨大豆肉汤(TSB),并在30°C培养24小时。将培养物用蛋白胨盐稀释液(PSDF)按1:1000稀释,并将50μl接种到50 ml测试培养基中。测试培养基为补充了1%葡萄糖和0.3%酵母提取物(TSYGB,Oxoid)的TSB。用1 M HCl调节pH至7.0、5.5、5.0和4.5。在pH 7.0肉汤中添加NaCl,使最终浓度分别为4%、6%和8%NaCl(w/v)。
在接种后立即以及在水浴30°C培养长达72小时期间间隔取样。样品在PSDF中稀释,并涂布到三个TSA平板上进行活菌计数。
2.1.3.生长实验
实验目的是获得许多单独体积的培养基,平均接种一至两个细胞。
将L.innocua从储备斜面传代培养至TSB,并在30°C培养24小时至稳定期。将培养物在PSDF中稀释至20个细胞ml^{-1}。将稀释培养物接种到两个百孔板的孔中(每孔50mu l)。然后每孔加入350mu l测试培养基(TSYGB pH 7.0,添加或不添加NaCl;或pH 5.5、5.0、4.5,不添加NaCl)。将加满的板置于Bioscreen C自动读数仪(Labsystems)中,在30{}^{circ}C培养。在长达7天的时间内定期在600~nm波长下监测浊度。
为了估计接种到每个孔中的细胞数量,将接种物培养物的稀释液涂布到TSA平板上,在30{}^{circ}C培养2天。
每种环境条件下实验重复两到三次。
2.1.4.检测时间
检测时间是孔内浊度达到0.11所需的时间。这对应于10^{7}个细胞ml^{-1}的浓度,并通过每种环境条件下的活菌计数进行验证。
2.1.5.读数准确性
通过在与生长实验相同的条件下进行实验来检查Bioscreen读数的准确性,但使用10^{7}个细胞ml^{-1}而不是20个。在最佳条件下,大群体的延滞期应是恒定的,因此孔间的变异性即为Bioscreen读数的变异性。
2.2.理论

•比生长速率在群体中是同质的,并且在初始细胞第一次分裂后是恒定的;
•每孔初始细胞数N_{0}遵循泊松分布。
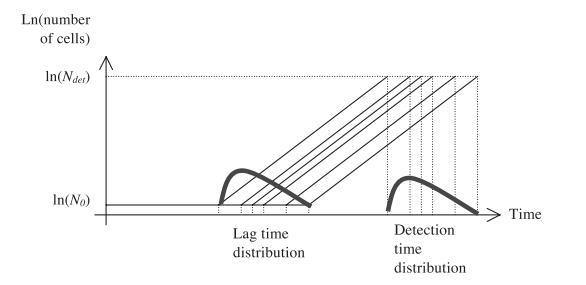
我们通过实验验证:
•检测水平对应于相同的细胞密度,无论研究条件如何。
•Bioscreen的OD测量不准确性(噪声)不显著。
•在相同生长条件下,检测时间值是可重复的。
相关新闻推荐
1、克鲁斯假丝酵母菌Y-7的生长曲线、抗逆性能及氨氮降解率研究(三)
