研究简介
这项研究聚焦于一种新型宿主靶向广谱抗感染小分子化合物C6,该化合物属于2-氰基-3-丙烯酰胺类DUB(去泛素化酶)抑制剂。面对全球抗生素耐药危机和抗病毒药物选择有限的严峻挑战,传统“病原体直接杀伤”策略逐渐失效,迫使科学界转向“宿主导向疗法”。该策略通过调控宿主自身关键生理过程以增强免疫清除能力,而非直接作用于病原体,从而有望突破耐药性瓶颈。本研究以泛素-蛋白酶体系统(UPS)为切入点,首次系统性验证了DUB抑制剂在抗细胞内病原体感染中的潜力。研究以两种细胞内病原体——鼠诺如病毒(MNV-1)和单核细胞增生李斯特菌(L.monocytogenes)为模型,前者为RNA病毒,后者为革兰氏阳性菌,二者均能在巨噬细胞内复制并逃避免疫清除。从39种结构优化的DUB抑制剂中筛选出化合物C6,其基于先导化合物WP1130和G9的核心骨架改造而成,关键创新在于通过卤素取代和侧链修饰显著降低细胞毒性(RAW 264.7巨噬细胞存活率>80%),同时保留甚至增强抗感染活性。实验表明C6在5μM浓度下预处理巨噬细胞30分钟,可使MNV-1病毒载量下降超过2个数量级(8小时),并使李斯特菌胞内增殖减少71.7%(28.3%残留),效果与G9相当但毒性更低。机制上C6通过抑制宿主DUB活性(如USP9x),导致泛素化蛋白积累,干扰病原体利用宿主泛素系统的策略。病毒入侵实验证实C6不影响MNV-1内化,但阻断其复制后期阶段。而对李斯特菌,C6既减缓细菌内化(内化率从0.89降至0.35),又持续抑制胞内增殖。
值得注意的是,C6对细菌的直接生长无显著抑制(仅轻微延迟),表明其抗感染作用主要通过宿主调控实现。药代动力学研究显示,C6在小鼠肝微粒体中的代谢半衰期为20分钟(短于G9的42分钟),但静脉注射后半衰期达4小时,血药浓度显著高于G9(7小时后54.9 ng/mL vs 4.9 ng/mL),提示其更适合静脉给药。这些特性使C6成为首个兼具高效抗感染活性和优良药物特性的DUB抑制剂候选物。本研究突破了传统抗感染药物开发的框架,首次证实通过化学干预宿主DUB可协同对抗病毒和细菌,为应对耐药病原体提供了“一石二鸟”的解决方案。未来研究将聚焦C6的特定靶点DUB鉴定、动物模型疗效验证及结构进一步优化,推动其向临床转化。这项成果不仅为泛素系统在感染免疫中的功能研究提供了工具,更为开发广谱、低耐药风险的抗感染药物开辟了新路径。
Bioscreen全自动微生物生长曲线分析仪的应用
评估测试化合物对野生型单核细胞增生李斯特菌菌株104035生长的毒性,将细菌培养至600 nm光密度(OD600)为0.5,并在含有无DUB抑制剂(未处理)或终浓度为2.5和5.0μM的化合物C6的BHI肉汤中按1:10稀释,并在含有DMSO(载体对照)的培养基中稀释,DMSO体积与所测试化合物体积相匹配。然后将培养物转移到100孔蜂窝板(2板),每孔300μl,一式三份,在Bioscreen C生长曲线分析仪中生长。平板在37℃下以中等速度连续振荡孵育18小时,并使用Prism6软件在线性刻度上绘图。
实验结果
化合物C6是一种新型的2-氰基-3-丙烯酰胺类去泛素化酶(DUB)抑制剂,具有显著的抗感染活性,能够有效抑制两种细胞内病原体——鼠诺如病毒(MNV-1)和单核细胞增生李斯特菌(L.monocytogenes)的复制。C6在细胞培养中表现出低毒性,对RAW 264.7巨噬细胞的存活率影响较小,优于先前的先导化合物G9。C6通过抑制宿主细胞内的DUB活性,增强宿主细胞的抗感染能力,而不是直接作用于病原体。C6通过抑制DUB活性,导致宿主细胞内泛素化蛋白的积累,从而干扰病原体的生命周期。C6在小鼠肝微粒体中的代谢半衰期约为20分钟,静脉注射后在小鼠体内的半衰期约为4小时,显示出良好的药代动力学特性。C6的血药浓度在静脉注射后维持较高水平,优于先导化合物G9,表明其具有更好的药物潜力。
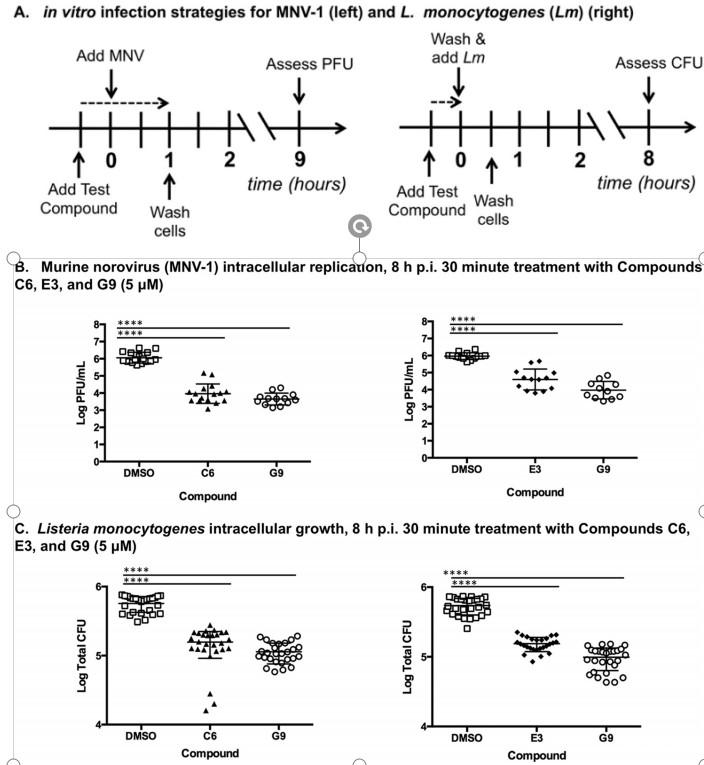
图1、39种小分子DUB抑制剂中的两种降低了MNV-1和单核细胞增生李斯特菌在RAW 264.7细胞中的细胞内生长,效果与母体化合物G9相似。(A)用于体外感染测试39种小分子化合物对MNV-1(MNV)(左)和单核细胞增生李斯特菌(右)抗感染作用的总体方案。(B和C)使用5μM化合物C6(左)和E3(右)对RAW细胞进行MNV-1。(B)和单核细胞增生李斯特菌(C)细胞培养感染的结果。还包括使用先前表征的化合物G9的结果。与载体(DMSO)处理的细胞水平相比,用化合物C6和E3处理导致病毒复制降低超过2个数量级,细菌生长减少超过50%(载体处理细胞的结果与未处理细胞无显著差异;未显示)。使用单因素方差分析(ANOVA)和Dunnett事后检验比较载体处理组和化合物处理组。
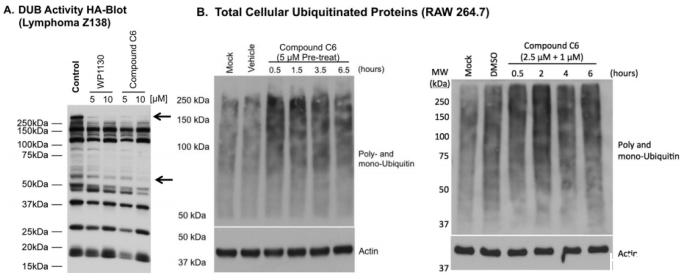
图2、化合物C6在人类细胞中抑制DUB活性并增加鼠细胞中的全局泛素化。(A)HA印迹显示WP1130和化合物C6在5µM和10µM浓度下的DUB抑制作用。箭头指示DUB活性抑制区域。(B)在鼠RAW 264.7细胞全细胞裂解物中使用抗泛素抗体(多聚和单泛素)进行的Western blot,采用30分钟5µM预处理(左)或30分钟2.5µM然后1.0µM(右)处理指定时间。印迹图代表三个独立实验,结果相似。
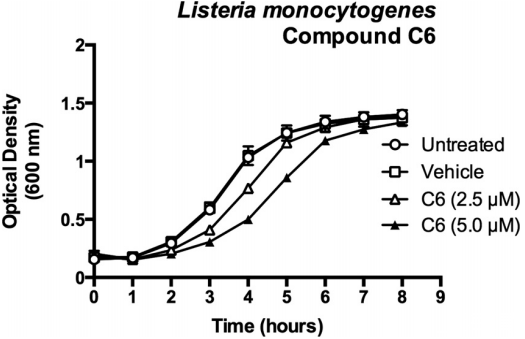
图3、单核细胞增生李斯特菌在化合物C6存在下的生长曲线。化合物C6对BHI肉汤培养物中单核细胞增生李斯特菌104035的体外生长产生剂量依赖性效应。该图绘制了两次独立实验中每种条件的三个重复样本的平均值,误差棒代表标准差。
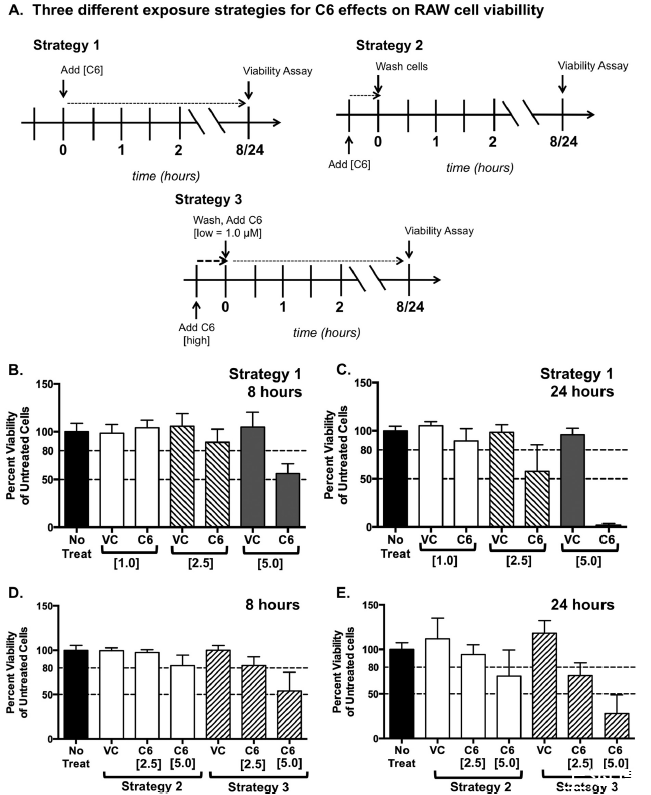
图4、化合物C6在多种处理条件下对RAW 264.7细胞活力的影响。化合物C6的浓度和暴露时间导致不同水平的细胞活力。(A)测试C6对RAW细胞活力影响的三种不同策略。策略1,持续暴露;策略2,仅预处理;策略3,变化暴露(较高预处理浓度和持续较低浓度,模拟感染方案)。虚线代表RAW细胞暴露于C6的时间。(B到E)RAW 264.7细胞的刃天青细胞活力测定。上面板显示根据策略1在8小时(B)和24小时(C)孵育后的细胞活力。下面板显示根据策略2和3在8小时(D)和24小时(E)后的细胞活力。结果以未处理细胞在570 nm处的吸光度百分比(活力百分比)显示。所示浓度为微摩尔。VC,载体对照。载体对照实验使用与C6处理组最高浓度体积相匹配的DMSO体积。
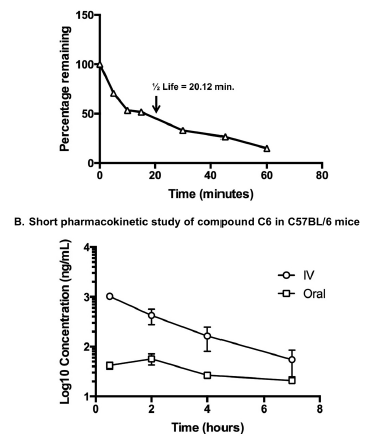
图5、C57BL/6小鼠肝脏微粒体中化合物C6的代谢稳定性和短期药代动力学研究。(A)化合物C6在小鼠肝脏微粒体中的LC-MS/MS分析。代谢半衰期为20.12分钟。(B)口服和静脉注射化合物C6的短期药代动力学分析(每种情况2只小鼠)。在给药后0.5、2、4和7小时测量血液中的浓度。口服剂量为30毫克/千克,静脉注射剂量为10毫克/千克。
总结
抗生素耐药性的上升和有效抗病毒药物数量的稀少,迫切需要治疗传染病的新方法。识别基于宿主的治疗靶点代表了药物发现的新兴策略。泛素-蛋白酶体系统是真核细胞信号传导的核心模式,可能是增强宿主控制感染能力的治疗的有前景靶点。去泛素化酶(DUB)是宿主炎症反应的关键调节因子,之前的研究已证明一种选择性DUB抑制剂及其衍生物在宿主细胞中促进抗感染活性。
为了寻找具有抗感染功效但改善毒性特征的化合物,本研究测试了一个主要由2-氰基-3-丙烯酰胺小分子DUB抑制剂组成的化合物库在巨噬细胞中对两种细胞内病原体。鼠诺如病毒(MNV)和单核细胞增生李斯特菌(Listeria monocytogenes)的抗感染活性。鉴定出化合物C6,它抑制人和鼠细胞中的DUB活性,并在细胞培养中毒性最小的情况下减少两种病原体的细胞内复制。用C6处理并未显著影响巨噬细胞内化病毒的能力,这表明抗感染活性干扰了MNV生命周期中进入后的阶段。
代谢稳定性和药代动力学测定显示,C6在小鼠肝微粒体中的半衰期约为20分钟,当静脉注射给药时在小鼠体内的半衰期约为4小时。本研究结果为在开发针对传染病的基于宿主的疗法中靶向宿主泛素系统提供了框架。化合物C6代表了一种有前景的工具,可用于阐明DUB在巨噬细胞应对感染反应中的作用。C6的发现为开发新型宿主导向疗法(HDT)提供了有力的候选化合物,这种疗法通过增强宿主的免疫反应来对抗多种病原体,而不是直接靶向病原体,从而降低了耐药性发展的风险。
Bioscreen C全自动微生物生长曲线分析仪主要用于评估化合物C6对单核细胞增生李斯特菌(L.monocytogenes)的直接抗菌活性,Bioscreen C的测试的生长曲线为研究团队提供了关键证据,证明C6的抗感染活性主要依赖于宿主细胞的调控机制,而非直接作用于病原体。这支持了宿主导向疗法(HDT)的合理性,即通过增强宿主的免疫反应来对抗多种病原体。未来的研究将集中在进一步探索C6的具体作用机制,包括鉴定其抑制的特定DUB酶及其下游靶点,以及在动物模型中验证C6的抗感染效果和安全性。C6作为一种新型DUB抑制剂,不仅在体外显示出良好的抗感染活性和低毒性,还具有优化的药代动力学特性,为开发新型抗感染药物提供了重要的基础。
相关新闻推荐
2、基于MIC和生长曲线分析植物乳杆菌SCB2505代谢物对液化沙雷氏菌的抑菌机理(二)
