研究简介
冷冻电镜的进步刺激了结构生物学的革命。然而对于接近大约40 kDa的冷冻电镜尺寸阈值的膜蛋白,包括转运蛋白和G蛋白偶联受体,缺乏可区分的结构特征使得图像对齐和结构测定成为一项重大挑战。此外分辨样品中的多个蛋白质构象是冷冻电镜的一个主要优势,但代表着更大程度的难度。本研究介绍了一种利用冷冻电镜(cryo-EM)解析小分子MFS(Major Facilitator Superfamily)转运蛋白结构的新策略。MFS转运蛋白是最大的次级转运蛋白家族,参与多种物质的跨膜运输,但其结构解析面临挑战,尤其是对于接近冷冻电镜大小阈值(约40 kDa)的膜蛋白。研究人员通过在MFS转运蛋白的C末端引入一个刚性的基准标记(fiducial marker,BRIL域),并利用AlphaFold2预测蛋白质结构,成功解析了金黄色葡萄球菌转运蛋白NorA的四种结构,包括向内开放、向内封闭和封闭构象,其中三种构象来自单一样本。该策略通过将目标蛋白的最后一个跨膜结构域螺旋与BRIL的第一个螺旋通过短的聚丙氨酸连接,增强了螺旋性,从而提高了图像对齐和结构解析的准确性。实验结果表明,这种融合蛋白在与特异性抗体(BAG2)结合时表现出较高的稳定性,并且在冷冻电镜下能够解析出清晰的结构。此外,研究人员还验证了该方法对其他MFS转运蛋白(如GlpT、Bmr和Blt)的适用性,表明这种策略可能对大多数MFS家族成员都有效。该研究不仅为解析小分子膜蛋白的结构提供了一种新的、高效的方法,而且对于理解MFS转运蛋白的功能和机制,以及开发针对这些蛋白的药物具有重要的推动作用。
Bioscreen全自动微生物生长曲线分析仪的应用
使用E.coli C43(DE3)菌株,分别转化含有野生型NorA、NorA-BRIL3A和一个失活突变体NorA(E222Q/D307N)的质粒。将转化后的单菌落接种到含有100μg/mL卡那霉素的LB液体培养基中,加入20μM IPTG诱导表达,37°C过夜培养。将过夜培养的菌液按1:200的比例稀释到新鲜的LB培养基中,加入20μM IPTG和100μg/mL卡那霉素。同时,向培养基中加入不同浓度的诺氟沙星(norfloxacin),浓度范围从0μg/mL到1.6μg/mL,以评估不同浓度下细胞的生长情况。使用Bioscreen全自动生长曲线分析仪设备在30°C下进行培养,每隔15分钟自动测量一次OD600nm(光密度值),以监测细菌的生长情况。
实验结果
开发了一种基于冷冻电镜(cryo-EM)的基准辅助策略,用于解析小分子MFS(Major Facilitator Superfamily)转运蛋白的结构。通过在MFS转运蛋白的C末端引入一个刚性的BRIL(Bacteriorhodopsin-like)域作为基准标记,并利用AlphaFold2预测蛋白质结构,研究人员成功解析了金黄色葡萄球菌转运蛋白NorA的四种结构,包括向内开放、向内封闭和封闭构象。验证了该方法对其他MFS转运蛋白(如GlpT、Bmr和Blt)的适用性,表明这种策略可能对大多数MFS家族成员都有效。通过分析1,118种MFS转运蛋白的结构,研究人员估计约50-75%的MFS转运蛋白可以通过C末端融合BRIL域来解析其结构。这些结构的解析验证了设计策略的有效性,并展示了该方法在解析多种构象中的优势。
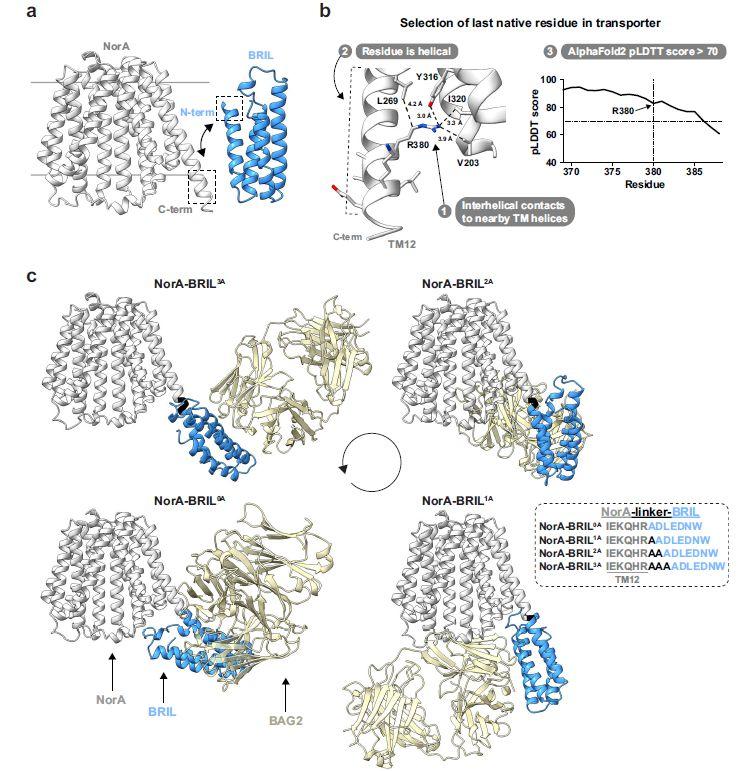
图1、NorA-BRIL结构的设计和预测。a)共享螺旋方法的示意图,其中NorA的C端螺旋(灰色)与BRIL的N端螺旋(蓝色)相邻,如虚线框所示。b)选择转运蛋白序列中要保留的最后一个天然残基的三个推荐标准。对于NorA,选择Arg380是因为它是TM12螺旋中满足三个标准的最后一个残基。c)融合蛋白序列和NorA-BRIL-BAG2结构模型的预测。左:复合物的NorA-BRIL部分(灰色的NorA;蓝色的BRIL)是使用AlphaFold2预测的,而BAG2(淡黄色)是通过将BRIL-BAG2(PDB ID:6CBV)34的晶体结构中的BRIL与NorA-BRIL AlphaFold2预测中的BRIL进行比对来建模的。
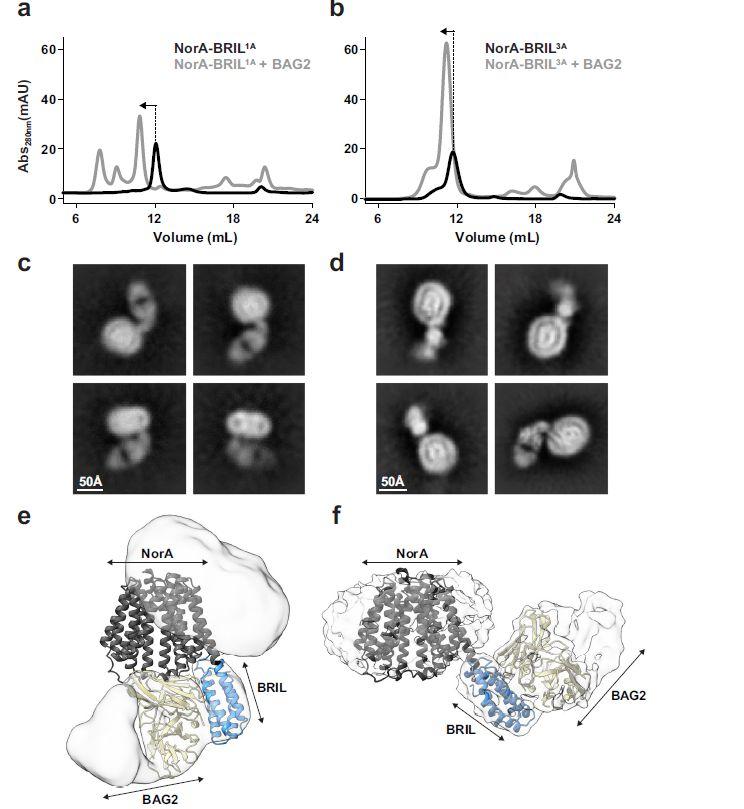
图2、NorA-BRIL1A和NorA-BRIL3A与BAG2复合物的结合实验和冷冻电镜。a、b在pH值为7.5的PMAL-C8中,在不存在(黑色迹线)或存在3倍过量的BAG2(灰色迹线)的情况下,NorA-BRIL1A(a)和NorA-BRIL3A(b)的SEC色谱图。箭头表示对应于单独NorA-BRIL或NorA-BRIL-BAG2复合物的SEC峰。在每个实验中,注射相同量的NorA-BRIL。对于NorA-BRIL1A,添加BAG2后,峰积分增加了1.41倍。对于NorA-BRIL3A,添加BAG2后,峰积分增加了3倍。c、d NorA-BRIL1A-BAG2(c)和NorA-BRIL3A-BAG2复合物(d)的示例性2D类别。(e)和NorA-BRIL 3A-BAG2复合物(f)的冷冻电镜图叠加,显示在部分透明的灰色表面,相应的预测模型显示在卡通中。
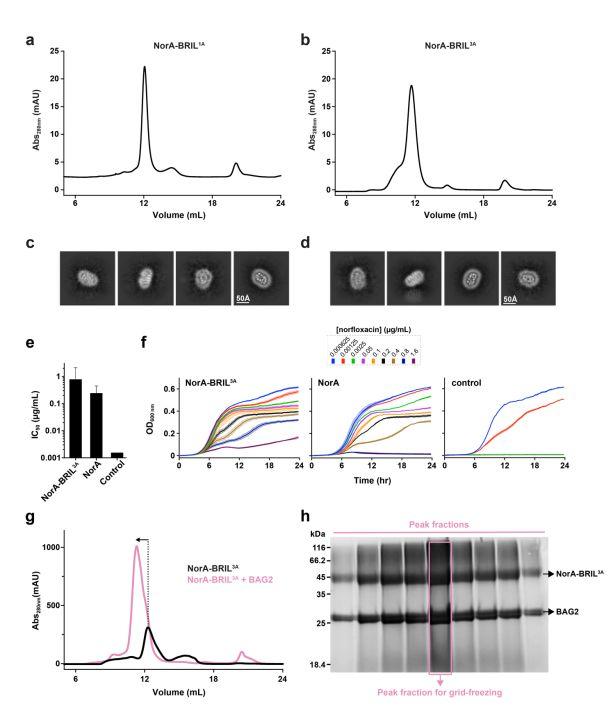
图3、NorA-BRILand NorA-的制备和表征。a、b)pH 7.5下PMAL-C8中NorA-BRIL。a,b.pH 7.5时PMAL-C8中NorA-BRIL1A(a)(b)NorA-BRIL3A的SEC色谱图。每次实验均注射等量的NorA-BRIL。c,d.与NorA-BRIL1A(c)和NorA-BRIL3A对应的2D类复合物的示例性。(d)面板c和面板d的颗粒总数分别为7,449和8,714。e,f)NorA-bril3a、NorA和对照的生长抑制曲线。测定在大肠杆菌C43(DE3)细胞中发现NorA突变体。记录OD600nm值作为时间的函数,不同颜色指示的诺氟沙星浓度(f)。抑制得到每个样品在24小时时间点(e)50%的浓度值(IC50)。类似生长抑制结果,即NorA-BRIL3A赋予强表型,被复制在总共四个独立实验中。g.在pH 5.0条件下重组为PMAL C8双酚的NorA-BRIL3A的SEC色谱图不存在(黑色)和存在BAG2(粉红色),后者用于制备NorA-BRIL3A-BAG2配合物用于低温电镜。h.NorA-BRIL3A-BAG2复合物对应峰段的SDS-PAGE凝胶。
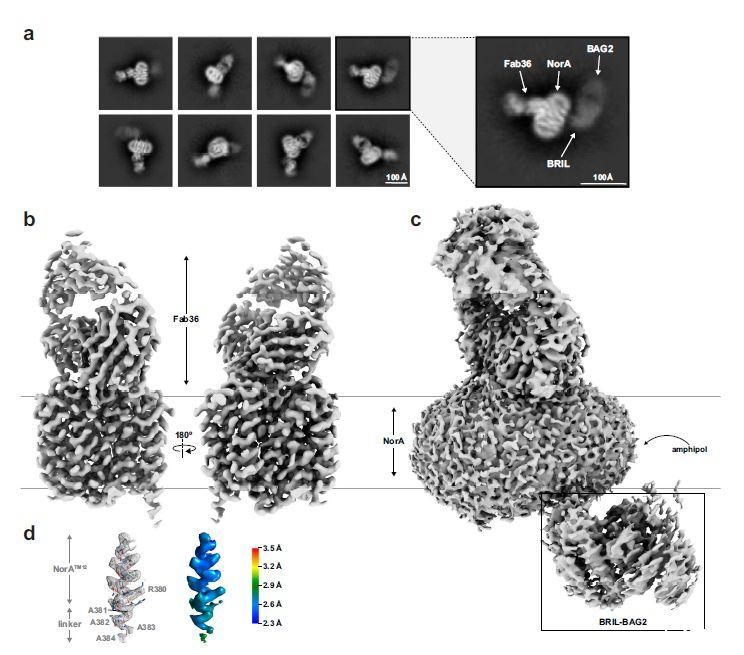
图4、NorA-BRIL 3A-BAG2-Fab36样品的冷冻电镜结果。a)pH值为7.5的NorA-BRIL 3A-BAG2-Fab36样品的示例性冷冻电镜2D类别。右侧的展开视图显示了其中一个2D类,表示复合物中对应于NorA、BRIL、BAG2和Fab36的区域。b)NorA-BRIL 3A-BAG2-Fab36样品的冷冻电镜图的两个视图显示在10σ处,其中σ是图的标准差。平行的灰色线表示含有NorA的脂质双层的表示。c)NorA-BRIL 3A-BAG2-Fab36样品的冷冻电镜图显示在3σ处。框区域对应于BRIL和BAG2域。d)NorA TM12部分的模型到映射叠加(左)和局部分辨率冷冻电镜映射(右)以及NorA-BRIL 3A-BAG2-Fab36样品中连接NorA和BRIL的丙氨酸接头。
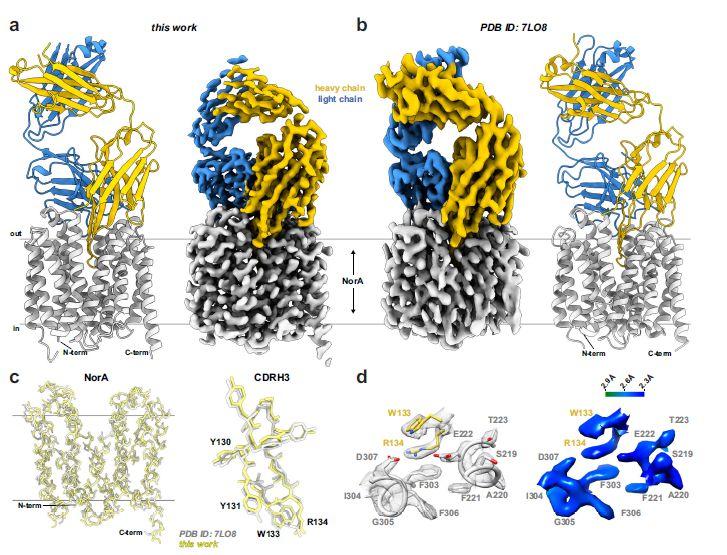
图5、使用BRIL融合方法提高了NorA向外开放的冷冻电镜结构的分辨率。a)NorA-BRIL 3A-BAG2-Fab36样品的结构(左)和冷冻电镜图(右),显示NorA(灰色)和Fab36(轻链为浅橙色,轻链为蓝色)。冷冻电镜图的总体分辨率为2.56Å。冷冻电镜图以10σ显示,其中σ是图的标准差。b)已发表的NorA-Fab36复合物的结构(右)和冷冻电镜图(左),显示NorA(灰色)和Fab36(轻链为浅橙色,轻链为蓝色)18。冷冻电镜图的总体分辨率为3.16Å。冷冻电镜图以10σ显示。c)NorA-BRIL 3A-Fab36(淡黄色)和NorA-Fab36(PDB ID:7LO8,灰色)结构的NorA(左)和CDRH3(右)的叠加。NorA和CDRH3的主干r.m.s.d.值分别为0.626Å和0.554Å。d)模型到图拟合(左)和局部分辨率冷冻电镜图(右)显示了插入NorA底物结合口袋的CDRH3环周围的选定区域。
总结
冷冻电镜的进步刺激了结构生物学的革命。然而对于接近大约40 kDa的冷冻电镜尺寸阈值的膜蛋白,包括转运蛋白和G蛋白偶联受体,缺乏可区分的结构特征使得图像对齐和结构测定成为一项重大挑战。此外,分辨样品中的多个蛋白质构象是冷冻电镜的一个主要优势,但代表着更大程度的难度。在这里研究人员描述了一种在AlphaFold2中来自主要促进子超家族(MFS)的膜转运蛋白的C末端引入刚性基准标记(BRIL结构域)的策略。这种方法涉及通过短的聚丙氨酸接头将靶蛋白的最后一个跨膜结构域螺旋与BRIL的第一个螺旋融合,以促进螺旋性。将这种策略与BRIL特异性Fab相结合,研究人员阐明了42 kDa金黄色葡萄球菌转运蛋白NorA的四种冷冻电镜结构,其中三种来自对应于向内开放、向内闭塞和闭塞构象的单个样品。因此,这种融合构建体促进了表征NorA构象景观的实验,并验证了设计,以避免与转运蛋白发生空间冲突,从而将BRIL/抗体对定位在方向上。后者是通过AlphaFold2预测实现的,这最大限度地减少了猜测并减少了筛选多个构建体的需要。
研究人员进一步验证了该方法对另外三种MFS转运蛋白(GlpT、Bmr和Blt)的适用性,结果支持转运蛋白和BRIL之间的刚性连接蛋白。成功应用于四种MFS蛋白,这是自然界中最大的次生转运蛋白家族,以及对该家族的预测结构的分析表明,该策略将成为使用冷冻电镜研究其他MFS成员的宝贵工具。BioScreen全自动微生物生长曲线分析仪能够自动化地监测细胞在不同条件下的生长情况,每隔15分钟自动记录一次OD600nm值。这种高频率的监测使得研究人员能够精确地观察到细胞生长的动态变化,从而更准确地评估不同浓度诺氟沙星对细胞生长的抑制效果。通过比较不同浓度诺氟沙星下的生长抑制情况,研究人员能够明确融合蛋白是否保留了野生型NorA的抗生素外排功能,这对于验证融合蛋白的生物学功能具有重要意义。本研究为解析小分子膜蛋白的结构提供了一种新的、高效的方法,特别是在解析多种构象和与底物结合的结构方面具有重要意义。这种策略不仅提高了结构解析的分辨率,还减少了实验筛选的工作量,为未来的研究提供了宝贵的工具。此外该方法的成功应用为理解MFS转运蛋白的功能和机制,以及开发针对这些蛋白的药物提供了重要的推动作用。
相关新闻推荐
2、基于MIC和生长曲线分析植物乳杆菌SCB2505代谢物对液化沙雷氏菌的抑菌机理(五)
