1.4定向驯化
从YPD平板挑取生长较好的初代单菌落于YPD活化培养基中,在30℃、200 r/min下培养过夜,取1 mL的菌液4℃、5 000×g离心5 min收集细胞,用无菌水重悬,最终以初始OD600=0.2接种于抑制物浓度为0.2 g/L的驯化培养基中,在30℃、200 r/min下培养24−48 h,使得酵母细胞OD600值达到2.0−3.0左右(即进入稳定期),重复上述步骤2−3次,直至酵母细胞在当前浓度的抑制物胁迫下生长速度显著提高;接着,以相同的初始OD600值再次接种至抑制物浓度为0.4 g/L的驯化培养基中,培养至细胞达到稳定期,在此浓度下重复培养2−3次,以此类推,直至完成所有浓度批次的驯化。驯化结束后取菌液划线YPD平板培养,挑取生长良好的单菌落作为最终的进化菌株,接种至YPD活化培养基中振荡培养12−16 h备用,并甘油保存于−80℃。不同抑制物的浓度都是以0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 g/L梯度提高。
1.5进化菌株抑制胁迫下的生长
取进化菌株的活化液划线平板培养,挑取单菌落于适量无菌ddH2O中,使各个菌液的OD600保持一致,并将重悬的细胞稀释4个梯度(1、10、100、1 000倍),分别吸取4µL对应的菌液点样于添加了不同浓度抑制物的检测平板上,30℃倒置培养2−3 d,观察细胞生长情况并拍照保存。
1.6进化菌株的发酵性能监测
取进化菌株活化液,接种在含有50 mL的150 mL锥形瓶中,30℃、200 r/min培养12−16 h作为发酵种子液。取2.5 mL种子液以相同的OD600值接种至含有不同浓度抑制物的YPD发酵培养基中,30℃、150 r/min下振荡培养3−4 d,每隔一段时间取样测定葡萄糖、糠醛、对羟基苯甲酸、乙醇等物质的含量。
1.7样品分析
菌株生长量用紫外分光光度计检测,取不同时间段的发酵液于600 nm吸收波长下读取OD值。发酵液中的各物质含量测定用高效液相色谱法,其中葡萄糖和乙醇含量的检测用醇柱,柱温50℃,流速0.5 mL/min,流动相为5 mmol/L的硫酸溶液。
1.8基因组重测序
分别挑取出发菌株W303-1A和不同抑制物下驯化完成的单菌落于YPD液体培养基中,在30℃、200 r/min下培养24−48 h,待细胞生长至稳定期后,收集菌液,液氮快速冷却后,置−80℃存放待测。
重测序工作由生工生物工程(上海)股份有限公司利用Illumina测序平台完成。Illumina MiSeqTM得出的原始图像数据文件经CASAVA碱基识别(base calling)分析转化为原始测序序列(sequenced reads)。此外,对原始数据质量值等信息进行统计,并使用FastQC对样本的测序数据质量进行可视化评估。
2结果与讨论
2.1 W303-1A的定向驯化
以适合实验室研究的营养缺陷型单倍体菌株W303-1A作为出发菌株,分别以糠醛、对羟基苯甲酸以及糠醛+对羟基苯甲酸作为胁迫条件对其进行定向驯化,主要过程如图1所示。经过50 d的培养后涂布于含有2.0 g/L抑制物的YPD平板,将平板倒置于37℃恒温恒湿培养箱中,培养24−48 h分离单克隆。筛选得到糠醛抗性提高的5株菌,分别命名为F-1、F-2、F-3、F-4、F-5,对羟基苯甲酸抗性提高的菌株5株,分别命名为A-1、A-2、A-3、A-4、A-5,以及糠醛+对羟基苯甲酸抗性提高的菌株5株,分别命名为B-1、B-2、B-3、B-4、B-5。
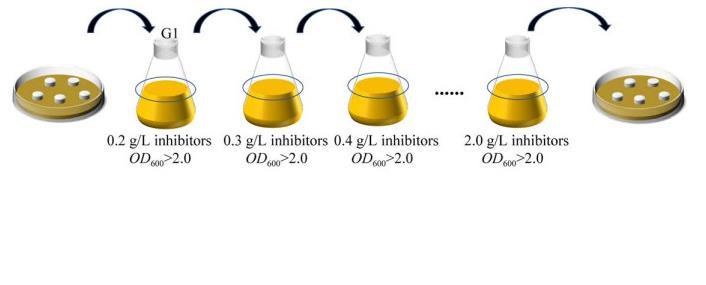
图1酵母抗抑制物驯化过程示意图
2.2抑制物胁迫下原始菌株和驯化菌株的平板生长情况
为了测试酿酒酵母W303-1A中经过一段时间驯化后是否能促进糠醛和对羟基苯甲酸胁迫下的生长性能,比较了经糠醛驯化后生长较好的5株菌(即F-1、F-2、F-3、F-4、F-5)和对照菌株(W303-1A)在含有不同糠醛浓度培养基中的有氧生长活性(图2A)。驯化后5株菌在糠醛为0.8 g/L的YPD板上能够较好地生长,而原始菌株在0.8 g/L糠醛的YPD培养基上生长相对较弱。原始菌株在1.2 g/L糠醛的YPD培养基上也能够存活,但生长速度远慢于驯化后的菌株。驯化后的5株菌在含有1.6 g/L糠醛的YPD的培养基中也可以较好地生长,而未经驯化的原始菌株则无法生长。当培养基中糠醛的浓度提升至2.0 g/L时,驯化的菌株中F-2的生长速度明显高于其他4株驯化菌株,以上结果表明,驯化后的菌株对糠醛产生了一定的耐受性,其中,F-2菌株的耐受性最好。

图2不同浓度的糠醛(A)、对羟基苯甲酸(B)和糠醛+对羟基苯甲酸(C)抑制胁迫下原始菌株和驯化菌株的平板生长情况
此外,本研究测试了经对羟基苯甲酸梯度驯化后的菌株耐受性。如图2B所示,挑取生长状态较好的5株驯化后菌株在含有0.8、1.2、1.6、2.0 g/L对羟基苯甲酸浓度的YPD培养基上生长,并评估菌落的生长情况。与原始菌株W303-1A相比,驯化后酵母菌株并无明显生长优势。此外,随着对羟基苯甲酸浓度的增加,驯化后的5株酵母细胞的生长情况与原始菌株W303-1A相似且均可以很好地生长。其中,驯化后的菌株在2.0 g/L对羟基苯甲酸条件下的生长优于对照菌株,这些结果表明,定向驯化能够一定程度上提升菌株在对羟基苯甲酸胁迫条件下的生长性能。
为了评估糠醛和对羟基苯甲酸的协同抑制对驯化菌株的毒性,测定了不同浓度糠醛和对羟基苯甲酸(0.8、1.2、1.6、2.0 g/L)的YPD平板上菌株的生长速度。图2C显示了原始菌株以及驯化后菌株的生长情况,对于驯化后的菌株,在0.8 g/L和1.2 g/L的抑制物浓度下未观察到生长抑制现象。随着抑制物浓度的增加,5株经驯化后的菌株细胞生长均受到明显的生长抑制,在1.6 g/L的浓度时,原始菌株已无法正常适应当前的环境,此外,驯化的菌株生长也受到了一定的抑制。尤其是在浓度2.0 g/L时,几乎所有的菌株均不能在培养基中生长。在添加0.8–1.6 g/L糠醛和对羟基苯甲酸的条件下,B-2的生长速度始终高于其他4株驯化菌株,以上结果表明,驯化后的菌株对抑制物协同作用的环境产生了一定的耐受性,其中,B-2菌株的耐受性最好。
相关新闻推荐
1、猫疱疹病毒Ⅰ型毒株HRB2019分离培养、增殖与鉴定方法(三)
2、砷氧化菌株在砷胁迫中生长曲线测定及重金属铜的耐受性(二)
3、烟草青枯病菌的生长曲线及对不同复合药剂的敏感性测定(一)
