5.AR拮抗性胆汁酸以AR依赖的方式促进抗肿瘤免疫反应
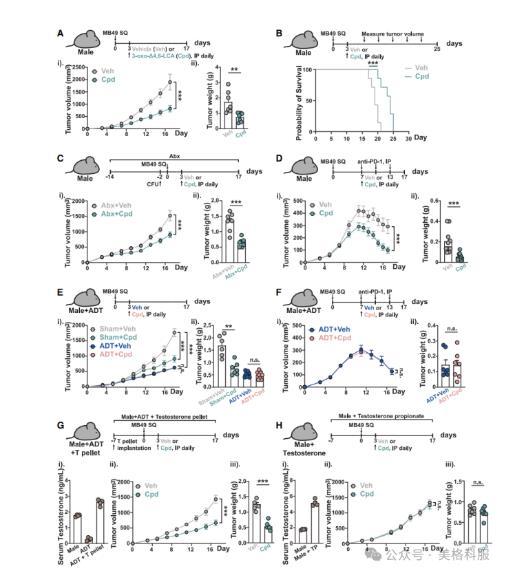
本研究评估了微生物群衍生的胆汁酸3-oxo-D4,6-LCA在体内的抗肿瘤作用及其与免疫检查点治疗的协同效应。研究发现,该BA通过拮抗雄激素受体(AR)显著抑制MB49荷瘤小鼠的肿瘤生长和转移,并提高整体生存率,其肿瘤抑制效果在很大程度上不依赖于肠道微生物。此外,3-oxo-D4,6-LCA还能增强抗PD-1免疫治疗的效果。进一步实验表明,在接受雄激素剥夺治疗(ADT)的小鼠中,该BA的抗肿瘤及免疫增强作用被消除,而在补充生理剂量睾酮的ADT小鼠中则恢复,说明其作用机制依赖于AR信号通路。药代动力学分析显示,该化合物在血清和肿瘤间质液中的浓度分别为约8μM和9μM,且未引起明显的肝毒性或胆汁酸谱紊乱。这些结果揭示了3-oxo-D4,6-LCA通过AR依赖机制发挥抗肿瘤和免疫调节功能。
6.3-oxo-D4,6-LCA促进具有干细胞样特性的肿瘤浸润性CD8+T细胞的分化与积累
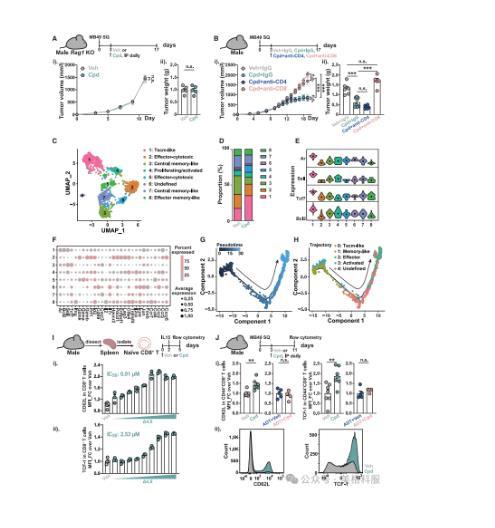
本研究深入探讨了3-oxo-D4,6-LCA在抗肿瘤免疫中的作用机制,发现其通过AR依赖途径促进具有干细胞样特性的肿瘤浸润性CD8+T细胞(Tscm-like)的分化与维持。实验表明,该BA并不直接抑制MB49肿瘤细胞生长,而是依赖宿主免疫系统发挥作用,在缺乏B/T细胞的Rag1敲除小鼠中失去了抗肿瘤效果。进一步分析显示,CD8+T细胞是介导其抗癌效应的关键细胞类型。通过对肿瘤微环境中CD8+T细胞进行单细胞RNA测序,研究人员发现3-oxo-D4,6-LCA显著富集了表达Tcf7、Sell和Bcl2等干性相关基因的干细胞样记忆T细胞亚群(cluster 1),并且这些细胞表达较高的AR水平,提示其对BA的响应可能与AR信号通路密切相关。轨迹分析揭示,该BA可诱导CD8+T细胞从干细胞样状态向效应细胞逐步分化。体外实验也证实,3-oxo-D4,6-LCA以剂量依赖方式促进初始CD8+T细胞向干细胞样表型分化。在体内模型中,该BA处理的小鼠肿瘤微环境中干细胞样CD8+T细胞比例显著增加,且这一效应在雄激素剥夺治疗(ADT)后被消除,验证了其AR依赖性。此外,在Pmel-1黑色素瘤模型中,该BA还增强了过继转移的肿瘤特异性CD8+T细胞的疗效,并提升其干性特征。综上,3-oxo-D4,6-LCA通过调控CD8+T细胞内在状态,促进抗肿瘤免疫应答。
7.3-oxo-D4,6-LCA的抗肿瘤作用及其对抗PD-1治疗的增强效果依赖于CD8+T细胞特异性的AR信号通路
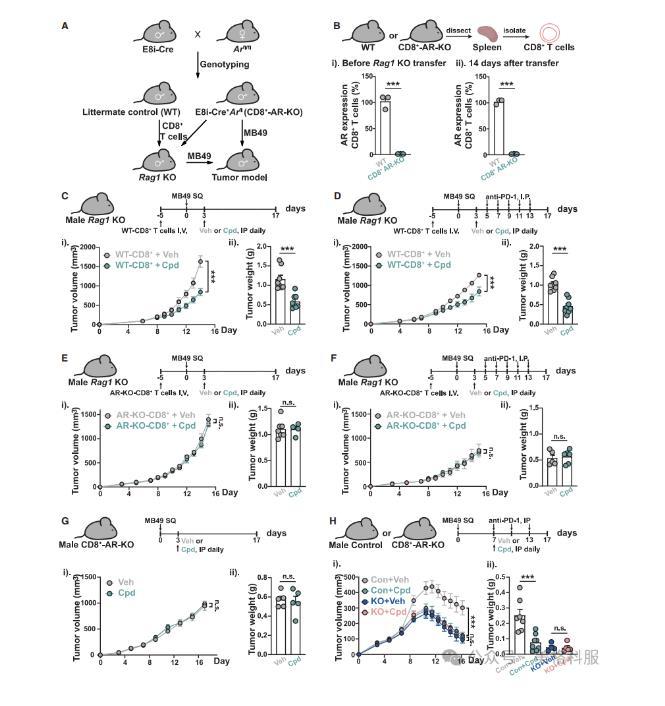
本研究进一步验证了3-oxo-D4,6-LCA的抗肿瘤作用及其增强抗PD-1疗效的能力依赖于CD8+T细胞内在的雄激素受体(AR)信号通路。实验显示,在重建野生型CD8+T细胞的Rag1敲除小鼠中,该BA可显著抑制肿瘤进展并增强免疫治疗效果;而在缺失AR的CD8+T细胞模型中,这些效应均被消除,表明其机制严格依赖于AR信号。此外,研究还发现3-oxo-D4,6-LCA可在体外促进人源CD8+T细胞向干细胞样记忆表型(Tscm)分化。在临床相关性分析中,研究人员发现这类AR拮抗性胆汁酸在人体中的浓度与血清前列腺特异性抗原(PSA)水平呈显著负相关(r=-0.40至-0.45,p<0.001),提示其在人类前列腺癌等疾病中可能具有生理意义。这些结果共同揭示了微生物来源胆汁酸通过调控CD8+T细胞AR信号来增强抗肿瘤免疫的机制。
结论
本研究系统揭示了肠道微生物群在塑造胆汁酸(BA)结构多样性及其调控宿主生理和疾病中的关键作用。微生物通过对初级胆汁酸进行去结合、脱氢、脱羟等修饰,生成结构多样的次级胆汁酸,这些BA通过与宿主核受体(如FXR、VDR、RORγ等)相互作用影响免疫调节和代谢等功能。本研究首次发现某些微生物来源的BA是强效的雄激素受体(AR)拮抗剂,其抗肿瘤和增强抗PD-1疗效的作用依赖于CD8+T细胞内在的AR信号通路。实验表明,这类BA通过促进肿瘤微环境中干细胞样CD8+T细胞的分化,增强抗肿瘤免疫反应,且该效应在去势或敲除CD8+T细胞中AR后消失。此外,临床数据显示这些AR拮抗性BA的人体浓度与血清PSA水平呈显著负相关,提示其在前列腺癌等疾病中的潜在意义。这些发现揭示了微生物代谢产物通过宿主受体(如AR)调控免疫与肿瘤的新机制,为开发基于微生物代谢物的免疫治疗策略提供了理论依据。
相关新闻推荐
2、链球菌、金黄色葡萄球菌、大肠杆菌对中性粒细胞活化能力的差异(四)
