研究简介
φR1-37是一种大型噬菌体,属于Myoviridae科,能够感染多种耶尔森菌血清型。其基因组为262,391 bp,包含367个蛋白编码基因和5个tRNA编码基因。研究中,通过在不同温度下进行生长曲线实验,发现φR1-37在4°C至37°C的温度范围内均能有效感染宿主细菌,且感染效率随温度升高而增加。RNA测序结果显示,随着感染时间的推移,宿主转录本逐渐被噬菌体转录本所取代,噬菌体转录本的比例从感染后2分钟的3.27%增加到49分钟的15.71%。本研究人员通过RNA测序技术深入探究了噬菌体φR1-37与宿主细菌小肠结肠炎耶尔森菌(Yersinia enterocolitica)之间的相互作用,揭示了φR1-37在溶菌感染过程中的全基因组转录模式以及对宿主细菌生理的影响。研究结果表明,φR1-37的基因表达模式与典型的溶菌噬菌体不同,其多数基因在整个感染过程中呈组成性表达,而宿主细胞的转录组在感染过程中发生了显著变化,包括一些特定基因的上调表达,这些基因与应激反应和膜稳定性相关。研究为理解噬菌体与宿主之间的相互作用提供了新的视角,并为进一步研究新型抗菌剂和噬菌体疗法的发展提供了基础。通过揭示φR1-37独特的基因表达模式和宿主转录组的变化,本研究强调了噬菌体在感染过程中对宿主代谢的复杂调控机制,以及宿主在应激条件下的适应性反应。
Bioscreen全自动生长曲线分析仪的应用
Bioscreen全自动生长曲线分析仪(Bioscreen C)被用于研究噬菌体φR1-37在不同温度条件下对宿主细菌小肠结肠炎耶尔森菌(Yersinia enterocolitica)的感染动力学。使用Y.enterocolitica O:3菌株YeO3-R1进行实验。细菌在LB培养基中过夜培养16小时,然后按1:10的比例稀释到新鲜的LB培养基中,总体积为10 mL。在细菌培养的OD600值达到0.6时,将培养物分为两部分:一部分用于感染噬菌体φR1-37(感染组),另一部分作为未感染的对照组(对照组)。感染组中加入噬菌体φR1-37,使其感染复数(MOI)为10;对照组中加入等量的培养基作为对照。实验在不同温度下进行,包括4°C、10°C、16°C、22°C和37°C。使用Bioscreen进行实验,将180µL的细菌培养物与20µL的噬菌体悬浮液(或对照培养基)混合在微孔板中。在设定的温度下,每隔一定时间测量培养物的OD600值,以监测细菌的生长变化。
实验结果
φR1-37的基因表达模式与典型的溶菌噬菌体不同。大多数基因在整个感染过程中呈组成性表达,而不是典型的早期、中期和晚期基因的阶段性表达模式。这种表达模式表明φR1-37可能依赖其自身的RNA聚合酶(RNAP)来维持整个感染过程中的基因表达。感染早期,约2.58%的Y.enterocolitica基因表达水平下降,表明噬菌体感染对宿主基因表达有显著抑制作用。感染晚期,54.2%的差异表达基因被上调,包括ABC转运蛋白、Cpx系统、噬菌体-冷-渗透压休克蛋白等,这些基因可能与宿主的应激反应和膜稳定性相关。这种上调可能反映了宿主对噬菌体感染的适应性反应,或者噬菌体对宿主代谢的调控。揭示了φR1-37基因组中存在10个新的非编码RNA种类,包括9个反义RNA(asRNA)和1个内基因RNA。这些非编码RNA可能在噬菌体-宿主相互作用中发挥调控作用,例如通过干扰宿主mRNA的转录或翻译。噬菌体感染过程中宿主基因的上调表达可能是一种复杂的适应性反应,噬菌体可能利用宿主的某些基因产物来完成其生命周期。这种相互作用可以被视为噬菌体与宿主之间的一种“军备竞赛”,宿主试图抵御感染,而噬菌体则试图利用宿主的资源来完成其生命周期。
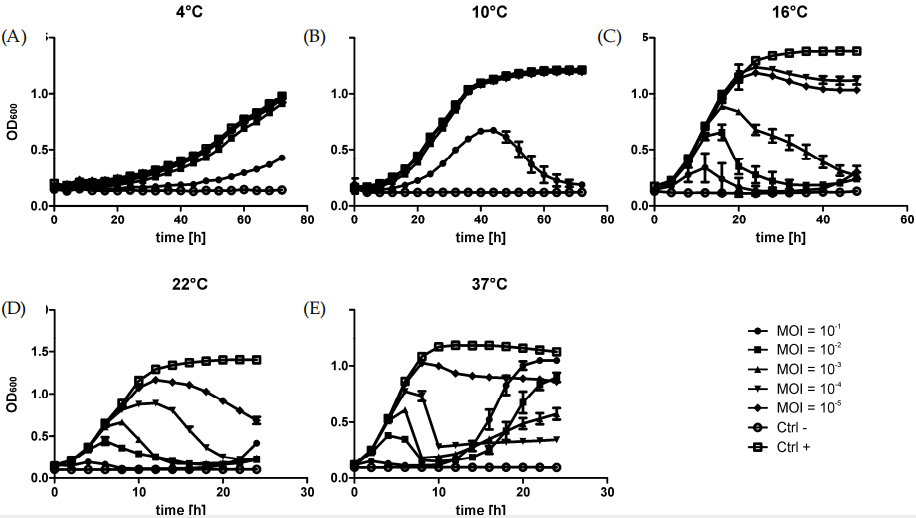
图1、在不同温度下感染噬菌体φR1-37的YeO3-R1细菌的生长曲线。在4℃(A)、10℃(B)、16℃(C)、22℃(D)和37℃(E)下,在LB中培养感染了MOI为10−1到10−5的噬菌体φR1-37的细菌。图中的每个数据点代表八次重复的平均值。误差线代表为每个时间点计算的光密度的标准差。
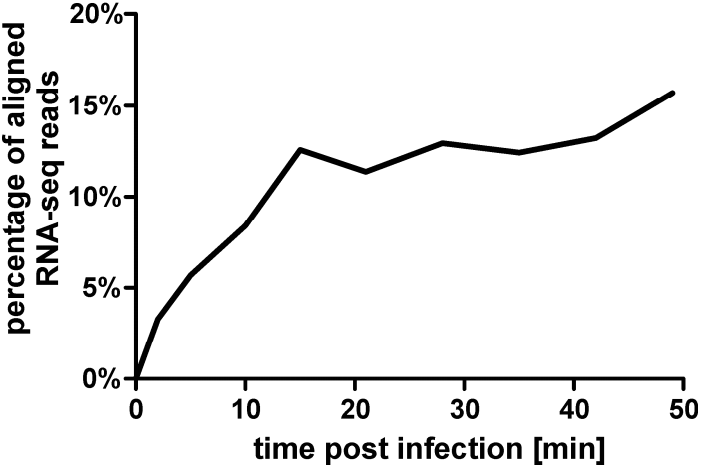
图2、感染后不同时间点比对到φR1-37噬菌体基因组的RNA测序读数的百分比。
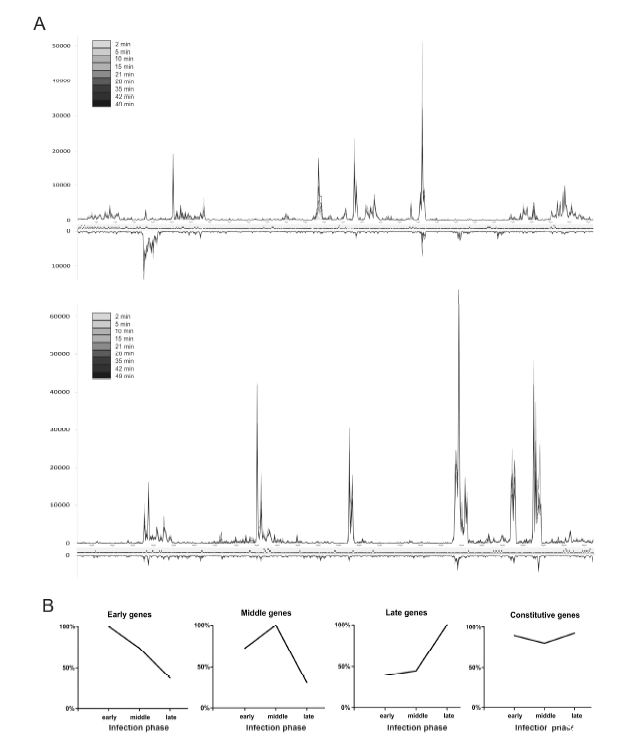
图3、φR1-37基因组转录在感染周期中的进程。将比对到噬菌体基因组双链每条链上每250bp片段的读数的数量针对每个时间点进行绘制(A)。曲线从灰色到黑色的颜色强度表示连续的时间点(关于图A的高分辨率图像,见图S4)。φR1-37基因表达的不同时间类别(B)。对于每个基因和感染阶段,最高的基因总读数(TGR)值被设为100%,其他值相应设定。基因被分为四个时间类别,曲线代表为这些类别计算的平均值。
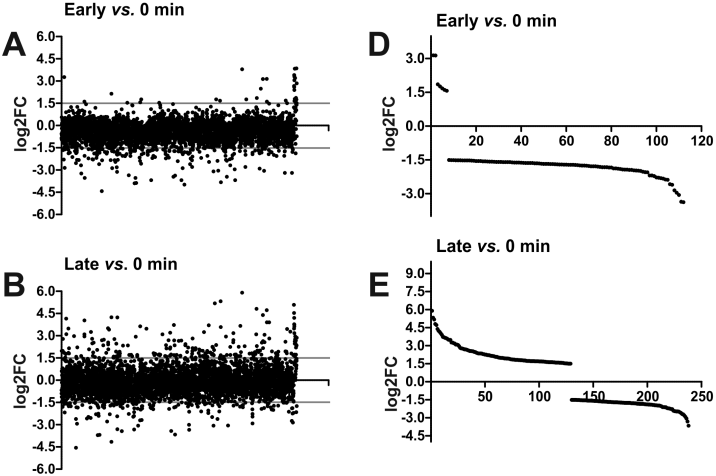
图4、在噬菌体φR1-37感染周期中细菌基因表达的变化。早期阶段数值代表为2和5分钟时间点计算的平均数据,晚期阶段数值代表为28、35、42和49分钟时间点计算的平均值。显示的是早期阶段与阴性对照之间的Log2FC值(A)、晚期阶段与阴性对照之间的Log2FC值(B)以及晚期阶段与早期阶段之间的Log2FC值(C)。每个点代表为每个基因单独计算的Log2FC值。在A、B和C图中,点根据它们在YeO3-R1基因组中的基因位置排序(X轴上连续的基因编号由底部的比例尺指示)。灰线指示选定的差异表达阈值±1.5。图D、E和F表明,在早期阶段,大多数差异表达的宿主基因被抑制(D),而在晚期阶段,许多差异表达的宿主基因被激活(E),当晚期阶段基因与早期阶段基因比较时,这一点更加明显(F)。
总结
对细菌病毒(噬菌体)的兴趣日益增长,但关于噬菌体在细胞内的发育及其对细菌生理学影响的见解仍然很少。研究人员研究了在裂解性感染过程中,巨型噬菌体vB_YecM_φR1-37(φR1-37)及其宿主——引起胃肠炎的细菌小肠结肠炎耶尔森菌(Yersinia enterocolitica)的全基因组转录情况。RNA测序显示,φR1-37的基因表达并不遵循在其他裂解性噬菌体中观察到的典型模式,因为只有部分基因可以被归类为典型的早期、中期或晚期基因。大多数基因似乎在整个感染过程中持续表达。研究表明转录主要发生在正链上,而负链仅编码低到中等表达水平的基因。有趣的是,还检测到了反义RNA(antisense RNA)的存在,以及一种非编码的基因内RNA(non-coding intragenic RNA)。噬菌体感染细胞中的基因表达特征在于宿主转录物被噬菌体转录物广泛取代。然而在感染晚期,宿主应答的特征也包括几种已知参与应激反应和膜稳定性的特定细菌基因产物的上调,包括Cpx通路调节因子、ATP结合盒(ABC)转运蛋白、噬菌体休克蛋白和冷休克蛋白。
通过Bioscreen C全自动生长曲线分析仪,研究者能够系统地评估噬菌体φR1-37在不同温度下对Y.enterocolitica的感染效率和宿主细菌的生长变化。实验结果表明,φR1-37能够在较宽的温度范围内有效感染宿主细菌,且感染效率随温度升高而增加。这一发现为后续的RNA测序分析提供了重要的实验基础,帮助研究者选择合适的感染条件(如室温下MOI=10)进行转录组学研究。本研究为理解噬菌体与宿主之间的相互作用提供了新的视角,并为进一步研究新型抗菌剂和噬菌体疗法的发展提供了基础。通过深入了解噬菌体感染机制和宿主响应机制,可以为开发新的抗菌策略提供理论支持。
相关新闻推荐
1、微生物生长曲线分析仪监测嗜麦芽寡养单胞菌及其突变体在NYG培养基中的生长情况
2、新型广谱阴沟肠杆菌噬菌体ZX14的分离鉴定、生长曲线、体体外杀菌活性实验(三)
