细胞方面,金黄色葡萄球菌能引起部分聚集,而大肠杆菌仅产生微弱聚集(图3A)。类似地,用固定化GAS菌株(n=4)刺激后检测到高水平的HBP和抵抗素,而固定化金黄色葡萄球菌(n=2)或大肠杆菌菌株(n=2)引发的水平显著较低(图3B、C)。使用细菌上清液(1:50和1:500稀释)刺激未能诱导HBP或抵抗素释放。中性粒细胞还受到纯化细菌蛋白(包括链球菌M1蛋白和内毒素LPS)的刺激。与细菌刺激实验一致,链球菌M1蛋白导致HBP和抵抗素的释放量显著高于LPS——后者对两种介质的释放均为弱触发因素(p<0.008)(图3D)。
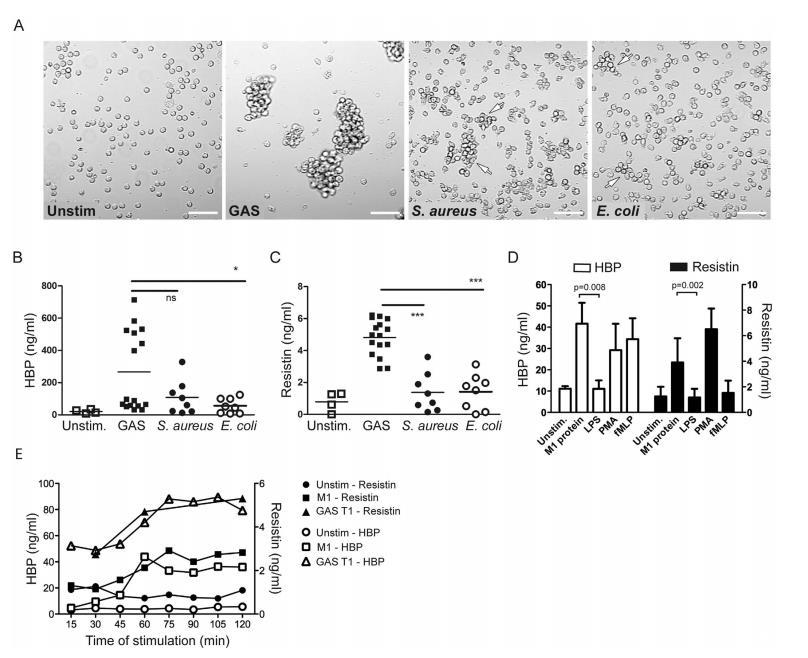
图3:HBP和抵抗素的释放因细菌刺激物而异。 从健康供体血液中分离的原代中性粒细胞用固定细菌或不同细菌成分刺激2小时。通过ELISA测定细胞培养上清液中的HBP和抵抗素水平。(A) 用指定细菌(20 cfu/细胞)刺激的中性粒细胞的显微镜明场图像。箭头指示聚集的中性粒细胞。比例尺表示100μm。(B, C) 用GAS (n=4)、金黄色葡萄球菌 (n=2) 和大肠杆菌 (n=2)(67 cfu/细胞)刺激的细胞上清液中的HBP和抵抗素水平。数据显示了使用不同供体进行的四次实验的结果。使用Kruskal Wallis检验与Dunns检验进行组间比较。(D) 用链球菌M1蛋白 (0.5 μg/ml)、LPS (50 ng/ml) 以及已知的中性粒细胞激活剂PMA (25 ng/ml) 和fMLP (5 μg/ml) 刺激的中性粒细胞上清液中的HBP和抵抗素水平。使用不同供体细胞进行的五次独立实验结果的均值±标准差。使用Mann-Whitney U检验进行组间比较,差异以p值显示,*P<0.05, ***P<0.001。(E) 用固定GAS T1菌株(67 cfu/细胞)或链球菌M1蛋白(1 μg/ml)刺激2小时的中性粒细胞上清液中HBP和抵抗素水平的动力学。该图显示了进行的两次实验中的一次代表性实验。
动力学实验显示,响应M1蛋白和灭活GAS,HBP和抵抗素释放的曲线相似,两种因子均在刺激后15-30分钟开始出现。
因此,数据证明了对不同刺激物的特异性中性粒细胞反应,以及链球菌诱导中性粒细胞活化后HBP和抵抗素的同步释放。因此,分析颗粒动员很有意义。为此,我们通过三重免疫荧光染色结合共聚焦显微镜比较了未刺激和刺激的中性粒细胞内的细胞内HBP、抵抗素和嗜苯胺蓝标记MPO。在未刺激的中性粒细胞中,检测到每个因子的许多阳性颗粒。大部分HBP和抵抗素阳性颗粒也含有MPO,证实它们存在于嗜苯胺蓝颗粒中。然而,只有少数颗粒对HBP和抵抗素均呈双阳性。相反,用不同刺激物激活的中性粒细胞显示出截然不同的颗粒染色模式,取决于刺激物。与未刺激细胞相比,链球菌M1蛋白刺激的细胞显示抵抗素和MPO以及HBP和抵抗素的共定位程度更高。HBP和抵抗素之间共定位程度的定量显示,与LPS刺激的细胞相比,M1蛋白刺激的细胞共定位增加显著更高。因此,数据与各种细菌刺激物引起的体外反应中注意到的差异一致。
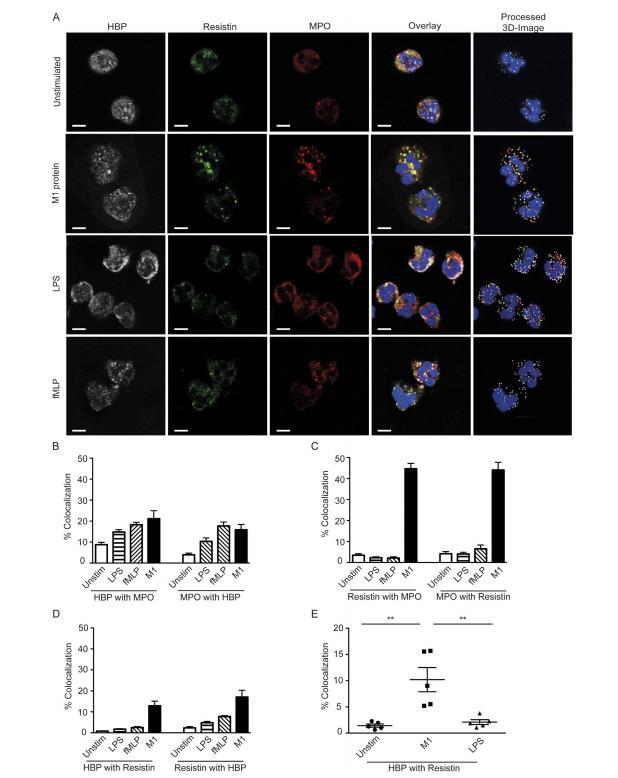
图4:中性粒细胞内HBP和抵抗素的亚细胞定位。 分离健康供体的中性粒细胞,并用LPS (50 ng/ml)、fMLP (5 μg/ml) 或链球菌M1蛋白 (1 μg/ml) 刺激2小时。对中性粒细胞进行HBP(白色)、抵抗素(绿色)和MPO(红色)的免疫荧光染色,使用DAPI(蓝色)显示细胞核。使用扫描激光共聚焦显微镜获取细胞的Z-栈,并使用Imaris图像分析软件(处理后的3D图像)识别HBP、抵抗素或MPO阳性的囊泡。然后使用Imaris分析软件量化处理后图像中上述标记物的共定位程度。(A) 显示来自一名高反应者细胞的图像。比例尺表示5μm。(B-D) 所示因子之间的共定位百分比。(E) 未刺激或分别用M1蛋白或LPS刺激的中性粒细胞共定位差异。使用Mann-Whitney检验确定统计学显著差异,**P<0.01。数据代表使用不同供体进行的两次实验的多个视野分析结果。
链球菌激活中性粒细胞涉及多种表面相关蛋白。为了进一步探讨这种中性粒细胞刺激效应是GAS独有的还是其他链球菌物种共有的,我们包括了从脓毒性休克患者收集的B群、C群和G群链球菌,以及草绿色链球菌菌株,此外还有五个GAS菌株,包括血清型T1、T4和T28的菌株,以及一个未知类型的菌株。发现在测试的两个供体中,所有菌株都诱导了强烈的抵抗素反应,而它们仅在一个供体中引发HBP释放。这种个体间差异,特别是链球菌触发的HBP释放,可见低反应者或高反应者。先前已报道链球菌M1蛋白触发的HBP释放存在供体变异,并发现与高反应者中存在高抗M1蛋白特异性抗体滴度有关。与这份报告一致,对高反应者和低反应者血浆中抗M1蛋白抗体的斑点印迹分析显示,使用高反应者(供体2)的血浆时信号强于低反应者(供体1)。
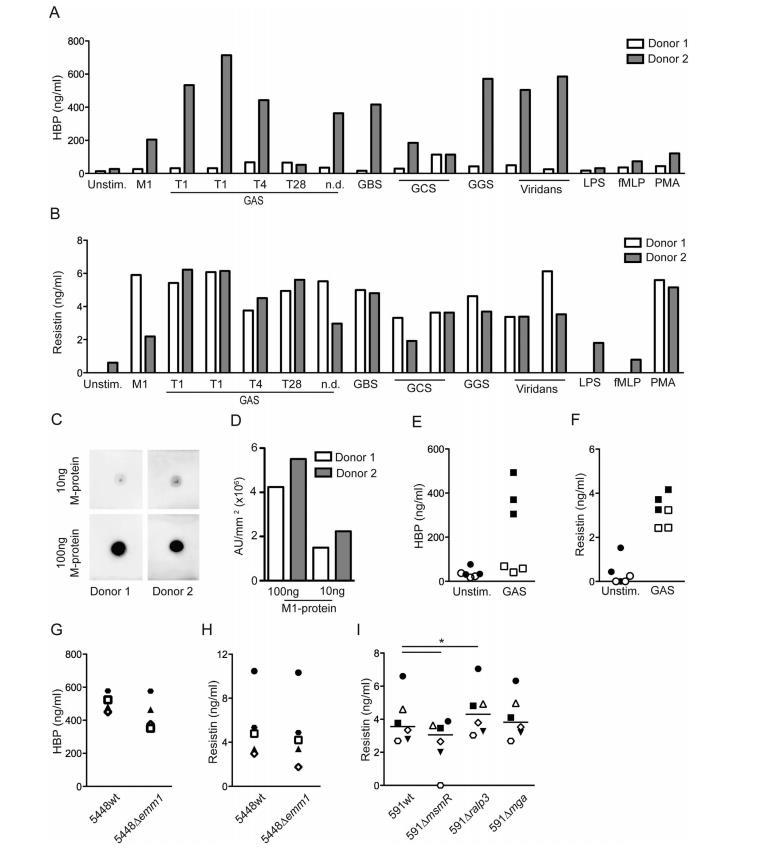
图5:链球菌物种具有显著的中性粒细胞刺激效应且涉及多种表面蛋白。 (A, B) 从两名供体(D1和D2)分离的中性粒细胞上清液中的HBP和抵抗素水平,这些细胞用不同的固定链球菌物种(67 cfu/细胞)刺激,如图所示。ND表示血清型未确定。(C) 通过斑点印迹分析检测高反应和低反应供体(D1和D2)血浆中的抗M1蛋白抗体。将纯化的M1蛋白(100和10 ng)点样到PVDF膜上,然后加入供体血浆并孵育过夜。使用HRP偶联的抗人IgG检测结合的抗M1抗体。(D) 对阳性染色强度进行定量,并绘制为任意单位 (AU)/mm²。(E, F) 在存在(实心符号)或不存在(空心符号)10%自体血浆的情况下,未刺激(Unstim.)或用固定GAS T1(GAS)刺激的中性粒细胞培养上清液中的HBP和抵抗素水平。该实验使用了三名不同供体的细胞。(G, H) 用固定野生型或相应的emm1基因同源缺失突变体刺激的中性粒细胞培养上清液中的HBP和抵抗素水平。显示了使用不同供体(由特定符号表示)进行的4-5次实验的结果。(I) 用固定野生型或相应指定基因的同源缺失突变体刺激的中性粒细胞培养上清液中的抵抗素水平。结果来自使用不同供体进行的五次实验, respective 供体由特定符号表示,线表示中位数。使用Wilcoxon匹配对符号秩检验进行组间比较,*P<0.05。
此外,其他血浆蛋白的存在,特别是纤维蛋白原,也被认为是链球菌M1蛋白触发HBP释放的重要因素。与这些报告一致,在存在或不存在10%自体血浆的情况下进行的刺激实验显示,灭活GAS触发的HBP释放具有血浆依赖性。值得注意的是,这种依赖性仅针对HBP注意到,而当血浆缺失时,抵抗素释放仅轻微减少,表明释放这两种因子需要不同的信号。
GBS、GCS、GGS和草绿色链球菌以与GAS相似的程度激活中性粒细胞,这一发现很有意义,因为它们共享几种表面附着因子,如M或M样蛋白、菌毛以及纤连蛋白和胶原结合蛋白。为了尝试识别刺激因子,我们首先通过使用5448的M1蛋白缺陷突变体探讨了表面附着M1蛋白的作用。然而,结果显示当用突变菌株刺激中性粒细胞时,HBP和抵抗素释放仅有轻微、不显著的减少;因此暗示其他表面附着因子以及可能涉及多种因子参与中性粒细胞活化。为了探讨这一点,我们利用了一组缺乏基因调节系统的GAS菌株,包括Mga(它是emm和emm样基因在Mga基因座内的正调节因子),以及MsmR和Ralp3(两者都影响编码纤连蛋白和胶原结合蛋白以及T菌毛的FCT区域)。与5448△emm1类似,591△mga突变体诱导的反应与野生型菌株相同。相反,591△msmR触发了抵抗素释放,但与野生型菌株相比水平显著降低,而591△ralp3触发了增强的反应。总之,结果暗示中性粒细胞的多因素激活涉及由FCT基因座编码的表面附着蛋白,而不是M和M样蛋白,作为中性粒细胞活化的触发因素。
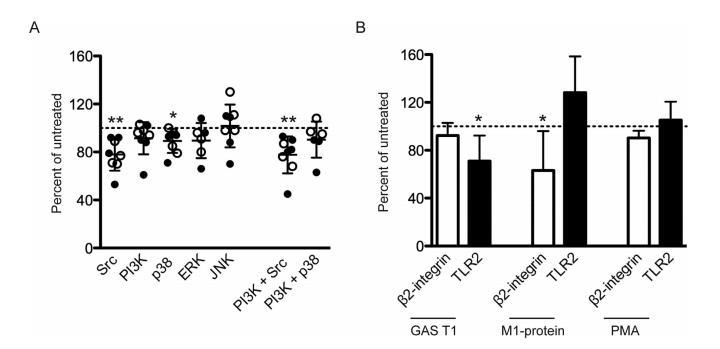
图6:参与抵抗素释放的信号分子和受体。 (A, B) 健康供体中性粒细胞细胞培养上清液中的抵抗素水平,这些细胞用靶向信号分子Src (PP1)、PI3K (LY294002)、MAPK p38 (SB203580)、ERK (PD98059) 和JNK (SP600125) 的抑制剂 (A) 或抗β2整合素(抗人CD18)和TLR-2(抗人CD282)的抗体 (B) 预处理30分钟,然后用固定GAS刺激2小时。在(A)中,空心和实心符号分别显示5448菌株和T1分离株。使用不同供体进行的3-9次实验结果的均值±标准差,表示为相对于未处理细胞的百分比,虚线表示100%。抑制剂不影响细胞反应,因为未刺激细胞在存在或不存在抑制剂的情况下具有相似的背景水平。使用Wilcoxon匹配对符号秩检验进行组间比较,*P>0.05, **P<0.01。
最后,我们探讨了参与中性粒细胞活化的宿主信号和推定受体。为此,将中性粒细胞与靶向Src家族激酶、磷脂酰肌醇3-激酶和MAPK p38、细胞外信号调节激酶和c-Jun N-末端激酶的抑制剂预孵育,然后用灭活GAS菌株刺激。与未处理的对照相比,在用Src家族激酶或p38抑制剂预处理的中性粒细胞中,注意到由GAS菌株引起的抵抗素释放持续减少。靶向PI3K的抑制剂也观察到小的效应,尽管不显著,而抑制ERK1/2和JNK没有效应。通过抑制PI3K+Src或PI3K+p38未实现反应的进一步降低。我们还通过使用封闭抗体测试了β2-整合素或TLR2是否参与这些反应。如先前报道,封闭β2-整合素导致链球菌M1蛋白引起的反应显著降低,但灭活GAS引起的反应没有降低。相反,当TLR2被封闭时,情况相反,对灭活GAS的反应降低。PMA引起的反应不受任一种抗体的影响。应该注意的是,抑制远非完全,这与涉及多个受体和信号的多因素激活一致。
相关新闻推荐
1、地衣芽孢杆菌的生长曲线测定、生理生化特性、益生性能研究(一)
