1.3.4 纤维素酶的测定
1.3.4.1 接种与培养
将固体曲培养料121℃、60min蒸汽灭菌,冷却至35℃左右,抢温接种待测菌株悬液。置30℃静止培养,每24h取样测纤维素酶活。
1.3.4.2 粗酶液的制备
称2.0g发酵曲,加蒸馏水20 mL,30℃水浴1h,每15min摇匀一次,3000r/min离心5min,取上清液为粗酶液。
1.3.4.3 纤维素酶活的检测
用3,5二硝基水杨酸(DNS)比色法,测定还原糖含量来确定FPA、CMC、C1三种纤维素酶活。
FPA滤纸酶活的测定:缓冲液2.0 mL,加入1× 6cm新华滤纸一张,50℃预热5min后加入0.5 mL酶液,50℃保温1h,取出加2.5 mLDNS试剂,煮沸5min,冷却后加水5 mL,540nm处测定还原糖。
CMC酶活的测定(内切葡聚糖酶):2.0 mL含5% CMC的缓冲液,50℃预热5min后加0.5 mL酶液,其余操作同FPA酶活的测定。
C1酶活测定:2.0 mL缓冲液中加入50mg脱脂棉,50℃预热5min后加入0.5 mL酶液,50℃保温24h,其余操作同FPA酶活的测定。
酶活单位U:采用国际制单位,即在上述条件下,每分钟产生1μmol葡萄糖的酶量为一个单位。酶活力即扣除参比溶液中还原糖后,每毫升酶液中所含酶活单位的量。
1.3.5 菌株鉴定
参考《伯杰氏系统细菌学手册》、《真菌鉴定手册》进行鉴定。
1.3.6 复合菌剂在粪便堆积发酵中最佳生长条件的研究
以牛粪为实验对象,在实验室模拟条件下,将牛粪自然风干至含水量50%以下,去除大块杂质,磨碎待用,按L9(34)正交设计各因素水平用稻壳粉、2%麦饭石粉、水等调节物料的C/N比以及水分、pH值后,高温灭菌,置于中号医用搪瓷盘中,上覆塑料薄膜保水,28℃±1℃培养,培养2d后,进行翻堆,4d测定活菌数。每处理3次重复,均等取样混合测定各数值。活菌数的测定参见农业部微生物肥料标准NY884-2005进行。正交设计各因素水平见表1。
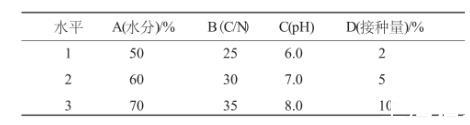
表1 复合菌剂在堆积发酵中最佳生长条件 L9(34)正交设计
2 结果与分析
2.1 纤维素分解菌菌种筛选及对滤纸、羧甲基纤维素分解能力的分析
对7种样品进行系统分离,初筛获得约20株菌,通过对菌落形态、生长速度的观察以及分解纤维素能力判定,挑选其中3株用PDA培养基平板进行分离纯化得到单个菌株B1、F1、F2。单个菌株B1、F1、F2以及它们相互混合对滤纸、羧甲基纤维素分解能力见表2、表3。从表2、表3可以看出:各菌株单独培养对滤纸、羧甲基纤维素均有一定的分解效果,但不如混合的效果好,B1、F1、F2混合培养8d时,滤纸失重率达到58.06%、酶相对活性0.93±0.00 cm·d-1,由此说明,3株菌株混合可以增加酶活力,各菌之间有很好的协同效应。
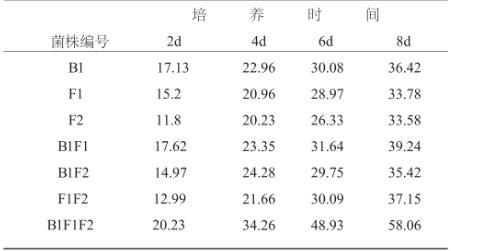
表2 不同培养时间的滤纸失重率/%
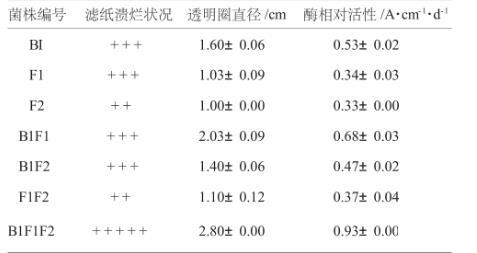
表3 不同菌株的纤维素酶相对活性及对滤纸的分解效果
2.2 纤维素分解菌酶活分析
结果见表4。从表4可见:B1、F1、F2菌株在固体曲中,都能很好地生长,随着培养时间的延长,酶活力提高,在培养5~6d时,酶活力达到最高。各菌株的FPA酶活力是B1F1F2>B1>F1>F2;CMC酶是F1>B1F1F2>B1>F2;C1酶是B1>B1F1F2>F1>F2。各菌混合后FPA酶活力显著增加,与各菌对滤纸、羧甲基纤维素分解能力的试验结果相吻合,进一步了证明菌种间的协同增效作用。基于酶活力大小的比较及生产成本的考虑,选择B1、F1菌作为堆肥发酵的试验生产菌。
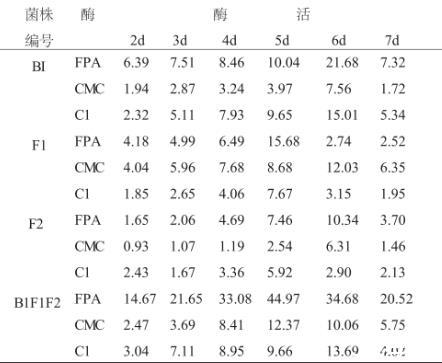
表4 不同菌株固体曲的纤维素酶活分析 单位:U/ml
2.3 菌株的鉴定
B1、F1菌株生长迅速,在察氏培养基上28℃培养7d,直径7~8cm,菌丝初期为白色,后期呈绿色,产孢丛束区摆列成同心轮纹,培养基背面成无色,培养基颜色不改变。分生孢子从菌丝的侧枝上生出,直立,分枝,小枝对生,顶端不膨大,上生分生孢子团,分生孢子球形,浅色或无色。F2菌株生长迅速,在察氏培养基上28℃培养7d,直径7~8cm,菌丝初期为白色,后期呈青绿色,培养基背面呈无色,培养基颜色不改变。营养菌丝有隔膜,分生孢子梗从菌丝垂直生出,孢梗顶端不膨大,分枝一次,顶端为小梗,分生孢子串成不分枝的链状,单个孢子球形,卵圆形,绿色。
根据各菌株的菌落特征和形态特征,按真菌分类鉴定手册和真菌分类学进行检索,初步认为B1、F1为木霉(Trichoderma),F2为青霉(Penicillium)。
2.4 复合菌剂在粪便堆积发酵中最佳生长条件的研究
以牛粪为研究对象,在实验室模拟条件下,采用L9(34)正交设计,研究物料水分、C/N、起始pH及接种量对复合微生物菌株生长的影响,结果见表5、表6。
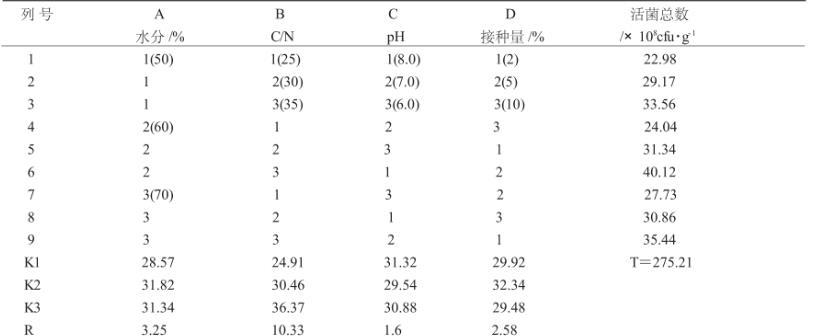
表5 沼渣堆积发酵工艺条件的确定
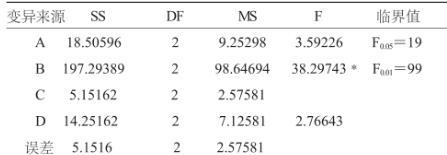
表6 沼渣堆积发酵工艺条件正交试验方差分析(完全随机模型)
从表5、表6可以看出,对微生物生长的影响各因素按极差大小主次顺序为:B>A>D>C,表明物料的C/N的比例对复合菌剂活菌数(生长)影响最大,物料pH影响最小。FB=38.29743>F0.05=19,达显著水平,表明B因素影响显著,所以对该因素应控制在最优水平上,A、D、C因素对复合菌剂活菌数(生长)对结果影响不大。综合以上分析,得到最佳堆积发酵工艺条件A2B3C1D2,即物料C/N为35、水分60%、接种量5%、pH=8.0。在此工艺条件下,适合菌剂中的微生物 生 长 繁 殖 ,活 菌 数 达 到 40.12×108cfu/g。
相关新闻推荐
1、温度依赖性生长曲线揭示φR1-37广谱感染特性及其转录重编程机制(三)
2、猪乳腺上皮细胞原代培养方法、生长曲线测定、IFA、PCR、免疫印迹试验鉴定(三)
3、香蕉细菌性软腐病菌sucA基因突变对细菌生长、毒力的影响——讨论、结论
