摘要:自然界中微生物种类繁多、功能多样、分布广泛,对人类健康安全、生态稳定和物种进化等发挥不可替代的作用。尽管微生物培养技术至今已有一百多年,然而由于各种限制因素的制约,目前成功分离培养的微生物仅占0.1%−1.0%,自然界中仍有十分丰富的微生物资源有待挖掘和开发利用。如何理解难培养微生物的制约因素并探索作用机制,同时借此开发新型微生物培养方法则尤为必要。本文首先分析了典型环境微生物生长的限制因素,然后介绍了目前利用传统培养改进措施进行分离筛选的研究成果,进一步综述了原位培养、共培养、微流控培养技术、细胞分选技术等新型培养技术在难培养微生物分离培养中的应用,最后对目前培养法存在的瓶颈问题进行深入分析,提出今后可在多技术联合使用、难培养微生物复苏机制、微生物互作机制、代谢途径与调控机制等方面进行研究,以期为今后微生物资源开发利用提供借鉴。
地球生物圈中微生物种类繁多、功能多样,它们扮演着生产者、消费者和分解者的角色,广泛参与碳、氮、硫等各种生物地化循环。据推算,大约有1011-1012种微生物存在于地球的各个生物圈中[1]。利用传统培养法分离微生物至今150多年,成千上万种微生物得以分离,但截至目前可培养微生物仅占总微生物的0.1%-1.0%[2]。绝大部分微生物无法培养,这些微生物常常被称为“暗物质”。尽管随着基于聚合酶链式反应(Polymerase Chain Reaction,PCR),如克隆文库、变性梯度凝胶电泳(Denatured Gradient Gel Electrophoresis,DGGE)、荧光原位杂交技术(Fluorescence in situ Hybridization,FISH)、实时荧光定量PCR(Real-Time Quantitative PCR,qPCR)、限制性片段长度多态性(Restriction Fragment Length Polymorphism,RFLP)和高通量测序等分子生物技术的蓬勃发展,越来越多的微生物通过免培养技术被发现,功能基因被陆续挖掘并利用。然而这些分子生物技术并不能替代培养法。其原因在于,即使通过(宏)组学技术发现了代谢途径独特新颖、功能强大的微生物,如果不能分离筛选这些微生物,其生理特点、代谢机制及生态功能就无法研究验证,应用也就无从谈起[3]。因此,测序法和培养法应互为补充,缺一不可。近年来,绝迹稀释法(Dilution-to-Extinction)、原位培养、共培养(Co-Culture)、流式细胞分选技术及微流控培养技术等新型培养方法陆续出现,为高效地分离筛选更多微生物带来了曙光。
本文首先分析了环境微生物生长的典型限制因素。然后,对传统培养法的改进措施、新型培养手段(原位培养、高通量培养法、微流控培养技术等)的原理、特点及优缺点进行介绍,分析并总结现今培养法的研究成果。最后,对目前培养法的瓶颈问题进行分析并提出解决措施,以期为今后利用培养法分离筛选更多微生物,特别是难培养的功能微生物的培养提供参考。
1未培养环境微生物生长的限制因素
自然界中生长的微生物在现有培养条件下不能生长,原因可能有7种。
1.1大多数未培养微生物处于活的非可培养状态
自然环境中有99%以上的微生物处于活的非可培养(Viable but Non-Culturable,VBNC)状态[4]。另外,人工实验条件会引起生长环境的改变,使原本能通过常规方法正常分离培养的环境微生物因无法适应而进入VBNC状态。这些VBNC微生物大多处于休眠状态,仅维持着最低代谢活性。然而,目前在实验室通过常规手段根本无法使其复苏并分离培养[4]。
1.2微生物的丰度和竞争能力低
在自然界复杂的微生物群落中,存在许多丰度低但代谢功能强的微生物[5]。鉴于目前研究人员仍无法确定这些低丰度微生物中相对丰度最高的微生物所生长的自然环境,导致无法进行有效富集;另外,即使某些微生物丰度相对较高,但如果培养基中底物丰富或以发酵底物作为碳源,在分离培养时,生长更快的微生物有可能迅速战胜生长缓慢的目标微生物,所以竞争力低仍可能导致培养失败[5]。
1.3无法模拟微生物生长的真实自然环境
由于对目的微生物所栖息的自然环境缺乏深入理解,例如,对微生物生长代谢过程中起关键作用的营养因子、不同生理阶段对基质浓度的需求、生长所需环境条件的变化规律等知识严重认识不足,导致在实验室条件下无法提供目的微生物生长所需的真实营养需求及培养条件。某种关键营养因子或生长条件不能满足往往会导致微生物的培养失败[6]。
1.4生长速率较低,检测手段不够灵敏
一些寡营养或生长缓慢的微生物细胞组成的超微型菌落,如果培养时间不够或者检测技术灵敏性不高,那么这些微生物的生长就不易被发觉,往往被忽略,表现为“未培养”[7]。
1.5培养基富营养化
由于自然界中数量庞大的环境微生物可利用的营养物质比较匮乏,多数处于“寡营养”状态[8]。高浓度营养物质比较适合生长快且对其有抵抗能力的微生物,但可能会抑制那些生长速度较慢的微生物[9],寡营养培养基可用于培养生长缓慢的细菌[10]。当微生物处于寡营养水生环境时,如果转移到富营养培养基中,会因不适应而突然死亡[10]。
1.6破坏或者忽视了环境中微生物之间的相互作用
自然界中的所有微生物并不是孤立存在,而是相互联系和影响的。许多微生物之间可进行物质交换和信号交流,它们联系紧密甚至高度依存。然而在实验室采用传统培养法分离筛选目的微生物时会人为破坏这种依存关系,导致分离培养的失败[11];另外,当前对环境微生物之间的这种高度复杂的互作机制研究并不多,认识不够深入、全面,导致不能指导难培养微生物的分离。
1.7病毒感染导致的培养效率降低
某些海洋环境样品中,7%的菌群携带病毒,表层海水死亡细菌中大概10%-50%是由病毒感染引起的[12]。
2环境中未培养微生物培养方法的开发与应用2.1常规培养方法的改进
环境微生物的生长除了需要适宜的生长条件和常规的碳源、氮源等营养物外,可能更需要信号分子、关键酶或蛋白及电子供体/受体等某些关键营养物质,这些关键物质或有利于关键生化反应生物酶的合成而维持微生物必需的生命代谢活动,或可促进处于VBNC状态的微生物复苏以恢复其活性。
2.1.1培养基的优化与调整
(1)添加抑制剂、样品抽提液或菌液
添加某种抑制剂(如抗生素)以抑制非目的菌的生长。本课题组以酱香型大曲为研究对象,对培养基进行改进,添加抑制剂结合热处理,分离出一株耐热性良好的放线菌FBKL4.010[13]。样品浸提液含有丰富的营养物质,向培养基添加浸提液是传统培养的重要手段。Nguyen等利用土壤提取液(80%甲醇浸提)制备的强化培养基对根际土壤进行分离,成功培养了许多以前未培养的细菌菌株,化学分析结果表明,土壤浸提液中含有低分子量有机物组分供微生物生长[14]。另外,Xian等利用Tepidimonas SYSU G00190W上清液的改良培养基,用于西藏和云南温泉样品中Chloroflexi的定向分离,从这些培养基中分离出的大多数菌落为未培养的Chloroflexi,其中36个为潜在新物种;代谢组学研究表明,培养上清液含有多种低分子量的有机基质,可作为这些细菌生长的潜在营养物质[15]。
(2)添加信号分子、电子供受体等物质
在自然环境复杂的微生物群落中,微生物之间紧密联系、相互作用,它们之间通过信号分子进行信息交流。研究表明,信号分子环磷酸腺苷(Cyclic Adenosine Monophosphate,cAMP)和酰基高丝氨酸内酯(Acyl-Homoserine Lactones,AHL)可显著提高海洋细菌的培养效率[16]。Bruns等向培养基中加入AHL、cAMP等信号分子对富营养化湖泊天然浮游细菌进行培养,发现这种方法能促使细菌得到培养。其中,cAMP是最有效的信号分子,10μmol/L cAMP可使约占总数10%的微生物细胞培养出来,但培养出来的细菌如果不继续添加信号分子,则又停止生长[17]。高丝氨酸内酯(Homoserine Lactones,HSL)作为群体感应信号分子可改善微生物的培养状况[18]。Guan等向含低浓度铁的培养基中加入外源的铁载体和C8-HSL,发现原本在低浓度铁培养基上不能生长的海洋细菌也能形成菌落[19]。此外,根据微生物的特性,添加生长所需的电子供受体也可提高微生物可培养率[11]。Sorokin等以甲酸盐或氢作为电子供体,以单质硫、硫代硫酸盐或二甲基亚砜作为电子受体,对高盐环境的沉积物样品进行分离培养,最终分离到Halodesulfurarchaeum新属的8株菌[20]。
(3)添加维生素、生物酶或蛋白因子
Harbison等通过向培养基中添加维生素,从酸性沼泽中分离出一种专性厌氧、嗜酸的α-变形菌门(Alphaproteobacterium)新菌株,命名为CS4T[21]。另外,有研究者通过添加生物酶来提高微生物可培养率。Kim等通过向培养基中添加H2O2酶,成功分离培养了2株淡水放线菌acI谱系的新菌株,即Prochlorococcus和Pelagibacter[22];同时,添加超氧化物歧化酶(Superoxide Dismutase,SOD)和H2O2酶等可降低培养过程中优势菌种代谢所产生的自由基、过氧化物和一些拮抗物质的毒害作用,使微生物的培养效率提高[23]。对于VBNC微生物,添加藤黄微球菌分泌的复苏促进因子(Resuscitation-Promoting Factor,Rpf)有助于促进其复苏和生长[24]。余晓云利用藤黄微球菌Rpf从新疆土壤极端环境中分离筛选VBNC状态菌,共分离得到60株菌,其中VBNC菌48株,14株为潜在新种[25]。翟竟余也对制药废水样品进行VBNC菌的分离筛选,共获得了23株VBNC菌,包括Pseudomonas属内的新种细菌Pseudomonas pharmacopolae sp.nov.[26]。
(4)其他凝固剂代替琼脂或改进琼脂培养基制备方法
琼脂作为常规培养基的凝固剂,对某些微生物具有一定程度的毒害作用,从而降低了可培养率;而使用结冷胶作为凝固剂不仅对微生物没有毒害作用,还可能增强受琼脂抑制微生物的生长,凝固效果比琼脂更好[27]。2005年,Tamaki等研究发现结冷胶培养基上的菌落数比琼脂培养基上的多10倍,约60%为新种[28]。2009年,该团队又比较了琼脂和结冷胶对从淡水沉积物中微生物菌落形成的影响,结果发现,108株菌中有22株只能在结冷胶培养基上形成可见菌落,并表现出新种的潜质,剩下的86株在琼脂和结冷胶上都生长,但其中52株在结冷胶上生长得更快;此外,结冷胶还显著地促进了具有代表性的生长缓慢微生物Gemmatimonas aurantiaca的菌落形成[29]。
除了用结冷胶代替琼脂之外,有研究者还通过改进琼脂培养基的制备方法来提高微生物的可培养性。2014年,Tanaka等使用Gemmatimonas aurantiaca T-27T和3种代表性的环境样品(土壤、沉积物和水)作为接种物,综合比较了PT培养基(将磷酸盐和琼脂同时灭菌)和PS培养基(将磷酸盐和琼脂分别灭菌)上的菌落数目情况,结果表明,PS培养基上的菌落数更多,对PT培养基进行化学分析表明H2O2抑制了微生物生长[30]。2018年,Kato等也利用PT培养基和PS培养基同时分离筛选森林土壤或池塘底泥的微生物,结果发现,在PS培养基上的菌落数目明显多于PT培养基,经过7 d以上的培养分别从PS培养基和PT培养基中分离出了98株和74株菌落作为慢速生长菌,通过PS培养基筛选到了一株α-变形菌门的新菌株[31]。另外,其他研究者通过PS培养基分离筛选到难以培养的烷烃降解菌[32]和放线菌[33]。
对培养基进行优化与调整的方法经济实用、针对性较强、操作较简单,但对于一些需要其他菌株辅助才能生长的类群分离效果就较差。同时,由于人们对某些微生物的认识不全面,因此难以根据微生物的特性来设计合适的培养基。
2.1.2培养条件的优化
(1)延长培养时间
延长培养时间可大幅度提高未培养微生物的培养率,有利于生长缓慢的微生物生长,但应注意控制培养时间,因为培养时间越长,对微生物培养环境的无菌要求就越高[34],而且培养基的营养成分会随时间推移发生改变,可能会对微生物的生长产生不利的影响。Choi等通过采用寡营养培养基和延长培养时间从海洋沉积物中分离微生物,分离出2株新海洋细菌,即Mooreiaceae和Catalimonadaceae[35]。Sun等在处理高浓度有机废水的中温升流式厌氧污泥床反应器中,采用富集培养基并延长培养时间对微生物进行培养,培养14 d后,成功地从污泥中分离出一株新厌氧菌TC1T,将其命名为Flexilinea flocculi gen.nov.sp.nov.[36]。Pulschen等通过采用寡营养培养基、延长培养时间及选择生长缓慢的细菌,从南极土壤样本中分离微生物,成功地分离出了一些稀有的微生物,如Lapillicoccus、Flavitalea、Quadrisphaera、Motilibacter和Polymorphobacter[37]。贺瑞含从南北极环境中采集不同类型的样品,通过改进培养温度、延长培养时间,采用稀释R2A培养基分离出细菌约1 220株,其中包括182个潜在新物种[38]。
(2)绝迹稀释法
绝迹稀释法(Dilution-to-Extinction)是通过将环境样品中微生物群体总数稀释至痕量后再进行培养的方法[39],该方法降低了优势微生物的占比,可提高寡营养微生物的可培养率[40]。Stingl等采用改进的绝迹稀释法从俄勒冈海岸和百慕大海域中培养微生物,分离出17株SAR11新菌株,以及几株以前未培养的细菌种类[41]。Colin等采用绝迹稀释法将河口沉积物稀释至痕量后,采用384微孔细胞培养板分离硫还原菌,筛选到很多硫还原菌新种[39]。Jimenez-Infante等采用绝迹稀释法将红海表层水样接种于改良的低营养培养基,培养4周,结果得到2株SAR11新菌株,分别命名为RS39和RS40[42]。Bartelme等采用绝迹稀释法将从针叶林浅表层土壤中提取的微生物细胞稀释后,分别接种于2种培养基(这2种培养基的氨基酸和有机碳浓度相差100倍),于96孔板、16℃下进行培养,共分离出133株菌,其中包括以前未培养的菌株,这些菌株与Nakamurella、Nocardioides、Mycobacterium、Jatrophihabitans、Patulibacter、Conexibacter、Rhizobiales sp.、Reyranella和Microtrichales sp.strain AZCC_0197的序列最大相似性小于97%[43]。Henson等采用绝迹稀释法培养浮游细菌,成功分离了8个新属和7个新种的菌株[40]。
绝迹稀释法一般采用96孔或者384孔板进行高通量并行操作,提高了分离效率,但操作较复杂,周期较长。同时,由于每个孔的顶部空间是完全隔离的,因此很难供应气态底物;此外,当以小体积培养细胞时,由于孔内液体蒸发会导致培养物变干,从而不利于微生物生长[5]。
2.2共培养
自然生境中微生物之间的相互作用对群体生存来说非常重要[44]。这些相互作用通常是通过环境改变来介导的,微生物通过占用资源和排泄代谢产物来改变环境,从而影响自身和其他微生物的生长[45]。大多数共生菌对体外培养有抗性[46],对相邻细菌产生的信号和化学因子的生长依赖性可能是阻碍细菌离体生长最重要的因素[6]。营养缺陷型细菌的基因组较小,缺乏必要的遗传物质来编码必需的营养素,通常需要与其他细菌建立紧密的共生关系才能生存[6]。
自然生境中许多细菌依靠共生关系维系生长,有研究者通过添加细菌进行共培养来提高培养率,如:Nichols等通过添加辅助菌株分离出一种新的嗜冷杆菌属[47];海洋沉积物中的自养氨氧化古生菌在与硫氧化细菌共培养时被成功地富集和培养[48];D’Onofrio等发现在海洋沉积物中广泛存在铁载体依赖的未培养细菌,来自邻近物种的铁载体可以诱导其生长[49];共生异养菌(如交替单胞菌Alteromonas等)可通过清除H2O2促进原绿球藻属(Prochlorococcus)的生长[50]。此外,交互共生培养法(Cross-Feeding Cultivation)也可提高培养率,如Kaeberlein等研究发现虽然菌株MSC1和MSC2很容易在培养皿中维持生长,但只能在共培养中实现,同样,MSC1可以在培养皿中与另外2株菌(MSC4和MSC5)中的任意一株进行共培养[51];Bhuiyan等报道了由菌株GF9(Sphingopyxis)产生的卟啉型生长因子A-F在皮摩尔到纳摩尔浓度下,可诱导先前未培养的菌株ASN212(Leucobacter)显著增殖,但却对产生菌GF9自身产生了毒性,GF9菌株与ASN212菌株的共培养试验表明,ASN212菌株有助于GF9菌株长期培养[52];吴家法对共培养30 d后的微包埋微生物采用流式细胞仪分选,分选后分别用MR2A和共培养流出液进行培养,结果获得了100株细菌,其中8株疑似新种[53]。
共培养作为一种新型培养法,考虑了真实自然环境下微生物互作对微生物生长的影响,对于互生或共生关系的微生物针对性较强。但由于当前对微生物间的互作机制及其对生长特性的影响研究有限,所以成功筛选出的难培养微生物种类并不多,需要进一步加大微生物互作与生长之间关系的研究。
2.3原位培养
原位培养是将稀释的环境样品置于区室独立小孔中,用半透性膜(0.03μm/0.2μm)上下封闭小孔,最终将其放回原来所栖息的自然环境或模拟生境中进行培养。装置的孔之间互不干扰,由于半透膜的选择性,孔内外的微生物细胞无法进出半透膜,但自然环境中的某些信号分子或关键营养因子等小分子能穿透半透膜进入孔中,为微生物所利用,进而促进孔中难培养微生物的生长。原位培养法主要包括扩散室法、分离芯片法、Trap技术、I-tip技术和胶囊包埋技术。这些方法都是通过模拟目标微生物的自然环境进行分离培养,有利于微生物与微生物或与自然环境之间建立化学交流。有关原位培养方法的开发与应用如表1所示。
表1原位培养的应用
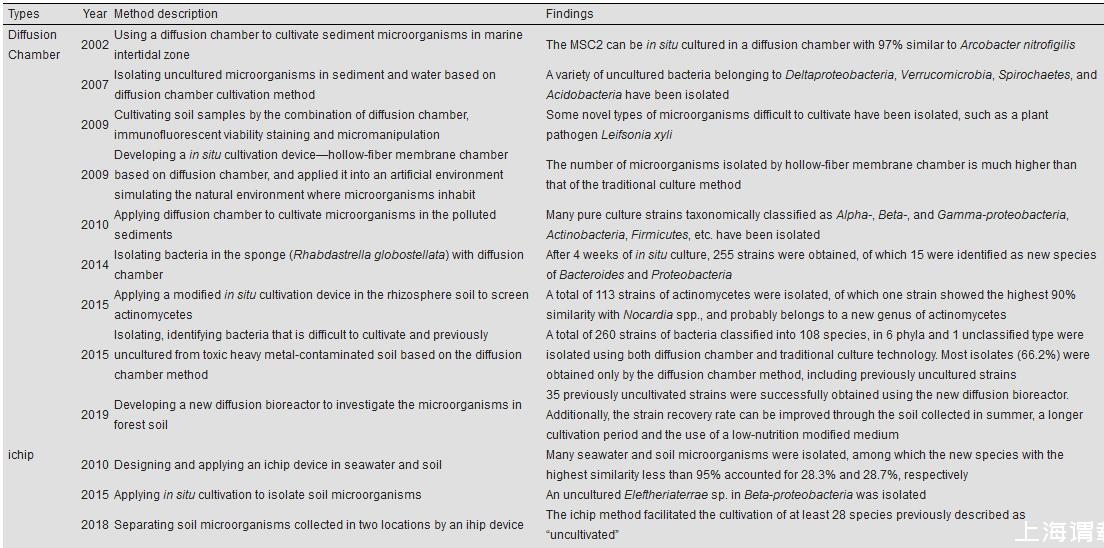

2.3.1扩散室
2002年,Kaeberlein团队设计了一种名叫“扩散室”(Diffusion Chamber)的装置(图1),可用于培养海洋潮汐带沉积物中的微生物,装置由金属环(垫圈)和紧贴两侧的半透性薄膜(孔径为0.03μm)构成[51]。将样品琼脂混合物注入装置密封后进行原位培养,培养过程中,营养物质会通过下层薄膜扩散到中间垫圈满足微生物生长,装置中的微生物也可与自然环境建立化学交流;但因薄膜孔径很小,所以装置内外的微生物不能相互扩散[51]。利用扩散室能提供环境微生物生长所需的营养,而不必弄清其确切成分,方便便捷;但仍存在一定的局限性,比如通过扩散室培养的环境细胞形成的菌落一般很小,肉眼不可见[63],较难检测和分离,也就很难进行高通量培养分离[73];样品的稀释水平会影响扩散室培养微生物的效果;对平板制作和膜材料选择要求也较高,不能破坏微生物生长[11]。

图1扩散室装置[51]Figure 1 Diffusion chamber for in situ microbial cultivation[51]
在此基础上,不同类型膜基系统已被开发并应用到自然环境样品的分离培养中,很多缓慢生长的菌落也可被成功培养[44]。
2.3.2分离芯片
在开发应用扩散室法培养微生物的基础上,Nichols等开发了一种名叫“分离芯片”(Isolation Chip,ichip)的高通量分离装置(图2),可用于大量分离培养环境中的未培养微生物[62]。使用时,将有上百个通孔的分离板放在已稀释的含样品微生物细胞的培养基悬液中(图2A),使每个通孔捕捉到含有适量微生物细胞的培养基(图2B),最后将分离板夹在聚碳酸酯膜(孔径为0.03μm)与上下两层板构成的半透性屏障中间(图2C),将装置置于目标微生物所栖息的环境中进行原位培养[62,74]。
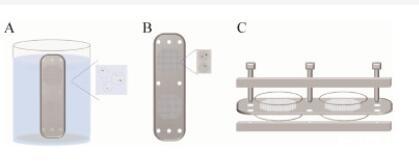
图2分离芯片[62]Figure 2 Isolation chip(ichip)[62]
通过实验证明,这种方法分离得到的微生物数量远远超过了传统分离方法,而且更有可能分离到新物种[73,75]。其原因可能是ichip中的细胞与外界环境的距离较近,信息交流更方便,会促进细胞生长;采用ichip法可进行高通量的分离培养;用显微镜观察每个小孔中生长的微生物,避免了菌落观察不到而被忽略的问题[11]。
2017年,Berdy等分别比较了ichip法和平板法分离培养海洋底泥和土壤中的微生物,发现无论是菌落数、菌落形态以及新种数目,ichip法均远远优于传统平板法;作者也总结了ichip法的不足:(1)某些微生物的生长不仅依赖于在自然界中特定生长因子和/或邻近物种的代谢产物,而且还需要共生微生物的物理接触;(2)该方法不能用于培养干旱环境的微生物;(3)将ichip放置在水生沉积物表面,但沉积物表面常常出现含氧层,会导致ichip下形成缺氧环境,使ichip孔内的细胞接触的是非自然的环境[76]。以上这些限制都会影响样品微生物的分离培养。
2.3.3 Trap技术
鉴于扩散室不能对放线菌进行选择性的分离,Gavrish等报道了一种用于分离丝状放线菌的Trap装置(图3),该装置的结构与“扩散室”相似,只是底部的半透膜孔径为0.2-0.6μm,孔径加大是为了能让菌丝体穿过半透膜进入生长盒,使用时将Trap装置(垫圈内最初为无菌固体培养基)置于盛有潮湿土壤样品的培养皿中,装置底部与土壤接触良好,丝状微生物选择性地渗入装置并形成菌落,黑暗条件下培养14-21 d[65]。
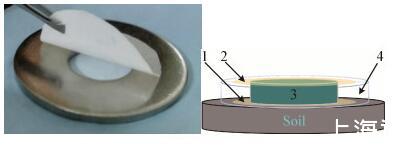
图3 Trap装置及示意图[65]Figure 3 Image and diagram of the trap[65]注:1:底膜(孔径0.2-0.6μm);2:顶膜(孔径0.03μm);3:无菌琼脂或结冷胶培养基;4:塑料或金属垫圈Note:1:Bottom membrane filter(0.2-0.6μm pore size);2:Top membrane filter(0.03μm pore size);3:Agar or gellan gum;4:Plastic or metal washer
2012年,Jung等开发了一种新Trap式的滤板微捕集器(Filter Plate Micro Trap,FPMT);FPMT是一种从自然环境中分离细菌的原位培养装置,以过滤微孔板为主体(图4A),长12.4 cm、宽8.1 cm、高3 cm,由96个独立的圆柱形空间作为培养微生物的腔室(图4B);培养时将装置放在土壤样品上,以诱集微生物进入腔室,微生物生长所需的某些营养物质也可扩散到培养基中[66]。
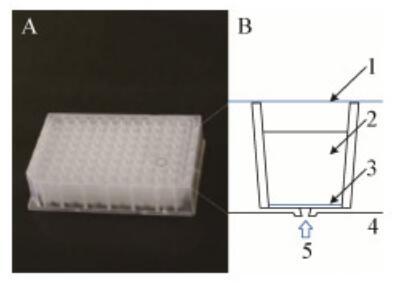
图4 UNIFILTER过滤微孔板照片(A)和FPMT一孔示意图(B)[66]Figure 4 Photograph of the UNIFILTER filtration microplate(A)and schematic diagram of one well of FPMT(B)[66]注:1:盖子;2:培养基;3:PVDF滤膜(孔径0.45μm);4:土壤或者底泥样品;5:微生物Note:1:Cover;2:Medium;3:0.45μm pore size PVDF filter;4:Soil or silt sample;5:Microorganisms
2.3.4 Isolation-Tip技术
2014年,Jung等开发了一种名叫“Isolation-Tip(I-tip)”的装置(图5),可用于分离海绵共附生微生物。使用时,将装置插入海绵的不同组织处(深度为0.5 cm)进行培养,4周后将装置中富集的细菌用平板法再进行分离培养[68]。I-tip法也存在一定的局限性,比如若要将装置应用在流动的海水中就需进行固定[77]。
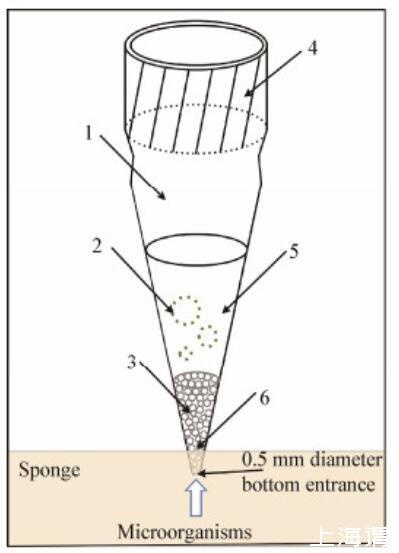
图5 I-tip装置示意图[68]Figure 5 Schematic diagram of the I-tip[68]注:1:黄色Tip(20-200μL);2:微生物在I-tip中培养;3:50-100、150-212μm玻璃微珠;4:防水胶布;5:0.7%琼脂培养;6:微生物由此进入I-tip Note:1:Yellow tip(20-200μL);2:Microbes are cultivated in I-tips;3:50-100,150-212μm glass beads;4:Waterproof adhesive;5:Medium with 0.7%agar;6:Microbes can penetrate between beads
2.3.5胶囊包埋技术
胶囊包埋技术又称为单细胞封装培养法、凝胶微滴培养法(Gel MicroDroplets,GMDs)。Zengler等设计了一个方法,将稀释后的环境样品与琼脂糖混合,乳化成微滴(即微滴包埋胶囊),然后将其装入层析柱内(层析柱用滤膜封口),包埋胶囊在低营养的流动培养液中进行培养,再结合流式细胞仪分选技术,将包含有单菌落的胶囊分选到含有培养基的96孔板中继续培养,最终获得纯培养物[69]。这是一个开放连续补充营养的微系统,微生物间的代谢产物及信号分子可在胶囊间进行扩散而被其他菌利用[44],较好地模拟了微生物的自然生长条件。该方法能高通量地分离培养微生物,而且更易进行下游的扩大培养,提高了微生物的培养率;但该方法成本较高、操作较复杂,而且存在一些技术问题,如包埋基质机械强度低、透性差、微生物热敏感等,因此还需要不断改进[78]。
原位培养技术通过模拟目标微生物的自然环境来分离培养微生物,有利于微生物与微生物或微生物与自然环境之间建立化学交流,可在一定程度上提高环境微生物的成活率以及未培养或稀有类群的培养率[79],但其成本较高、下游的分离纯化鉴定工作量很大、周期较长、操作较复杂、可控性差,即将人为模拟自然环境条件下培养的微生物转移到实验室条件驯化时,若选用的培养基和培养条件不适宜某些微生物的生长,就会使分离效率降低。
2.4微流控培养技术
微流控培养技术(Microfluidics Cultivation)是在微观尺寸下对复杂流体进行控制、操作和检测的技术,其能短时间同时检测多种未培养微生物的存在,还能获得目标微生物的纯培养物[80]。微流控培养和分析设备是在单细胞水平上研究微生物相互作用的通用工具,与传统培养方法相比,该技术制造工艺和技术设备复杂、专业性强[81]。
2014年,Najah等采用一种超高通量的液滴微流控技术,在不到20 min的时间内筛选超过100 000个细胞;通过将单个细菌在20μL液滴(含荧光纤维二糖水解酶底物的培养基)中隔室分离,直接从麦茬地筛选未培养细菌;根据纤维二糖水解酶活性对液滴进行分选后,细菌种群的纤维二糖水解酶和内切葡聚糖酶活性分别提高了17倍和7倍,并且与选择在含有淀粉和羧甲基纤维素作为碳源的培养基上生长时相比,分类学上的差异非常大[82]。2016年,Jiang等建立了一种微流控划线平板法(Microfluidic Streak Plate,MSP),从多环芳烃富集的土壤中分离到了许多未培养微生物,包括一株能降解荧蒽(Fluoranthene)的芽生球菌(Blastococcus)新种[83]。2019年,赵莹彤等设计并制备了一种微流控芯片,其单个元件是由上部带有凹槽的“U”型结构组成,该芯片能捕获真菌单细胞,对单细胞可正常培养48 h以上,并且能观察到酵母出芽、孢子萌发等过程,可用于真菌单细胞的捕获、培养、定位和实时观察,具有简单、方便、直观的特点[84]。
2.5基于细胞分选的培养技术
细胞分选技术通常用来从复杂的微生物群落中分离单个细胞并进行培养。目前细胞分选技术包括光学镊子和荧光激活细胞分选(Fluorescence Activated Cell Sorting,FACS)等,常与微液滴或微流控技术相结合。Irie等报道了一种利用细胞分选系统对活性污泥微生物群落中未培养的嗜酸菌和硝化螺菌进行物理富集的新方法[85]。Abe等报道了一种基于散射特征的高通量分离技术,将氨氧化细菌菌落直接从活性污泥中分离出来,避免了长时间培养和富集偏差,接种到含培养基的96孔板中进行培养,成功地分离出了亚硝化单胞菌属(Nitrosomonas)中的新菌株[86]。Fujitani等利用前向散射(Forward Scatter,FSC)和侧向散射(Side Scattering,SSC)结合的方式从富集样品中分离得到了3株硝化螺菌属中未培养的菌种[87],并报道了一种针对硝化细菌微菌落形成的分离方法[88]。与传统的细胞分选机制不同,此技术既能保证培养条件,又规避了种间竞争的影响,但该方法建立的时间较短、技术还不够成熟,还需继续探索[80]。
3总结与展望
随着以原位培养、微流控培养技术和细胞分选技术等为代表的新型培养技术的进一步成熟以及高通量测序的迅猛发展,越来越多的微生物被发现,特别是一些难培养微生物或微生物新种被成功地分离培养,但截至目前绝大部分微生物还是无法培养出来。究其原因,制约大部分微生物无法培养的原因有2个方面:(1)设备昂贵、操作复杂及技术要求高等因素导致原位培养、微流控培养技术、细胞分选技术等新型培养方法还无法广泛应用;(2)对环境微生物生长所必需的关键营养因子或信号分子的种类、VBNC微生物的复苏过程及机制、微生物互作机制、代谢途径及调控机制等的认识十分匮乏。
针对目前的研究状况,我们认为可从以下研究方向着手:(1)针对成功分离到的难培养微生物,从生理特点、代谢途径及营养需求等方面探索微生物可培养机理,破解其可培养的密码,为后续其他难培养微生物奠定理论基础;(2)传统培养法+新型培养法、培养法+多组学技术等方法的结合,取长补短。比如,将原位培养与共培养或者膜技术结合,既可以模拟自然生长环境,又考虑了微生物与微生物之间的相互作用。目前,培养组学[89]主要应用于培养和鉴定人类肠道微生物,未来可将该技术应用于环境微生物的分离培养;其次,多组学技术能够深入挖掘功能基因及微生物、揭示重要代谢途径,发现关键蛋白(酶)或代谢物,从分子层面探究微生物代谢途径和生理生化机制,以期寻找对难培养微生物生长起关键作用的营养物质以及培养条件。(3)研究群体感应(Quorum Sensing,QS)与复苏促进因子之间的关系,从微生物互作的角度揭示VBNC复苏机制。
相关新闻推荐
1、北极狐唾液乳杆菌ZJBF005生长曲线、产酸和耐酸曲线、抗菌活性测定(一)
3、链球菌、金黄色葡萄球菌、大肠杆菌对中性粒细胞活化能力的差异(三)
