导读
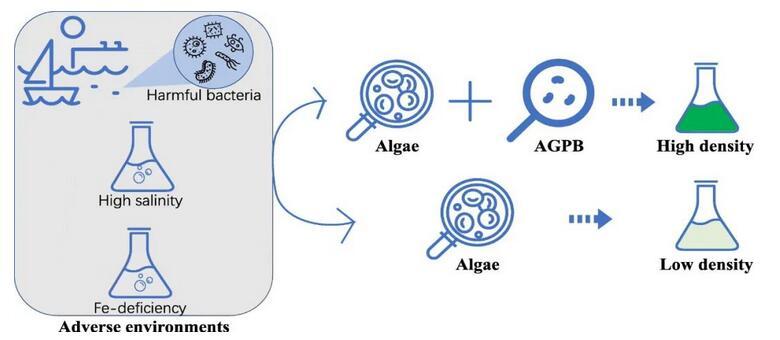
本研究旨在寻找能够在不利环境中促进小球藻(Chlorella)生长的微藻促生菌(microalgae-promoting bacteria,MGPB)。从4种小球藻中分离出50株共生细菌,并通过16S rRNA基因序列进行鉴定。功能筛选和二元培养实验将这些菌株中的43株列为MGPB。在不利环境条件下(缺铁、高盐度或不适宜的海水环境)观察到,MGPB处理的微藻的生长参数显著高于未接种对照,并且Dinoroseobacter shibae是最有效的菌株。以取自不同海域海水(S-海水和Q-海水)(均去除微藻并添加营养盐)为培养基,无菌小球藻在Q-海水中生长旺盛,但不能在交替单胞菌属(Alteromonas)和弧菌属(Vibrio)相对丰富的S-海水中生长。然而,当向S-海水中加入250μL/L的D.shibae时(OD600=0.1),小球藻则能旺盛生长。小球藻在接种D.shibae后的S-海水和Q-海水中的生长速率没有显著差异(P>;0.05),但均显著低于(P<;0.05)Q-海水。16S rRNA基因分析显示,在添加了D.shibae的Q-海水和S-海水中生长的微藻出现了相似的藻际细菌群落,表现为招募了更多的红杆菌科(Rhodobacteriaceae)微生物(例如Ruegeria sp.),更少的假单胞菌科(Pseudomonadaceae)微生物(例如Pseudomonas sp.)。这些结果表明,添加共生MGPB可以改变藻际细菌群落。在胁迫条件下接种MGPB对小球藻的生长有一定的促进作用,但在适宜的环境下可能无效。这些结果也表明,分离出的MGPBs,特别是D.shibae,可以开发为一种生物接种剂,用于在不利环境中初步建立小球藻群落。
实验设计
结果与讨论
1、微藻和细菌分离
将单藻种培养的小球藻Chlorella sp.HN11在液体和琼脂抗生素培养基上传代培养至少5代,获得无菌小球藻株(AHN11)。从4株小球藻中分离出50个可培养的共生细菌菌落,隶属于4门33属(包括7个未知种)(图1)。分离到的细菌80%属于变形菌门(Proteobacteria),共有27属40种;12%属于厚壁菌门(Firmicutes),有4属6种;6%属于放线菌门(Actinomycetes),有1属3种;2%隶属于拟杆菌门(Bacteroidetes),有1属1种。
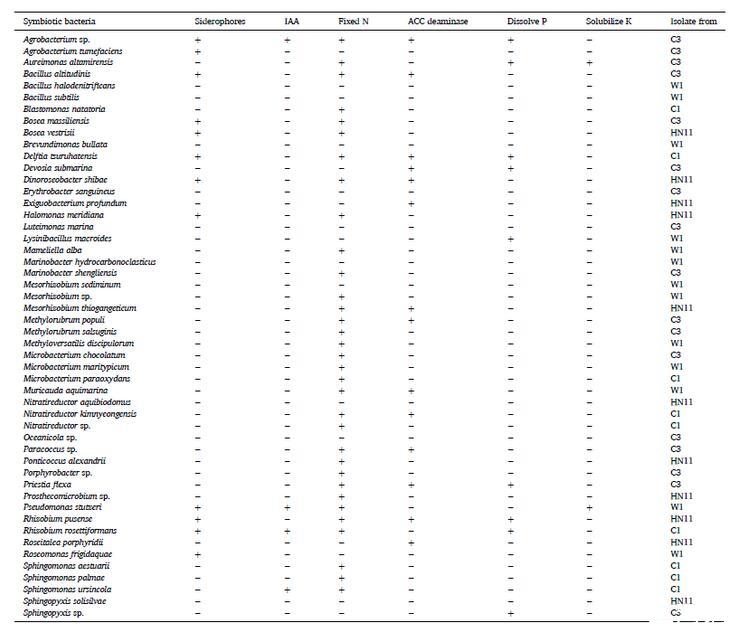
细菌功能结果显示(表1),有9株溶磷菌、2株溶钾菌、12株产铁载体细菌、33株固氮细菌、14株产ACC脱氨酶细菌和4株产IAA细菌。部分菌株具有多种功能,证明了有益细菌在微藻培养中的重要性。
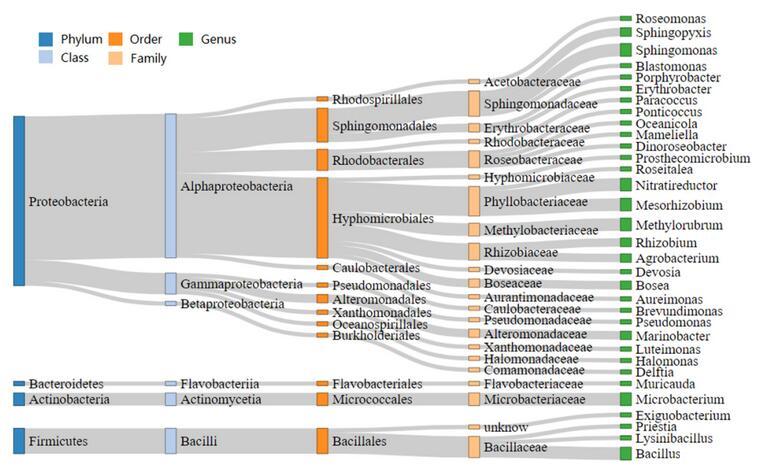
图1.Sankey图显示了本研究中分离的50种海洋细菌基于其16S rDNA序列的关系。
表1.分离的细菌及其筛选出的功能。
2、共生细菌和无菌小球藻的二元培
2.1、正常培养条件下
微藻表现出的生物现象与其伴生细菌密不可分。二元培养144 h后,结果表明,分离出的共生细菌中有86%(50株中有43株)对小球藻有积极的促生作用(图2),可归类为微藻促生菌(MGPB)。其中,D.shibae对小球藻的促生作用最好,而H.meridiana、M.aquimarina、P.flexa、M.populi、Mesorhizobium sp.、B.bullata和M.salsuginis对小球藻的生长无促进作用。所有分离出的共生细菌均显著提高了(P<;0.1)小球藻的最大荧光量子产率(Fv/Fm)(图2B),这意味着尽管共生细菌中有部分未表现出促生作用,但对小球藻光合是有益的。
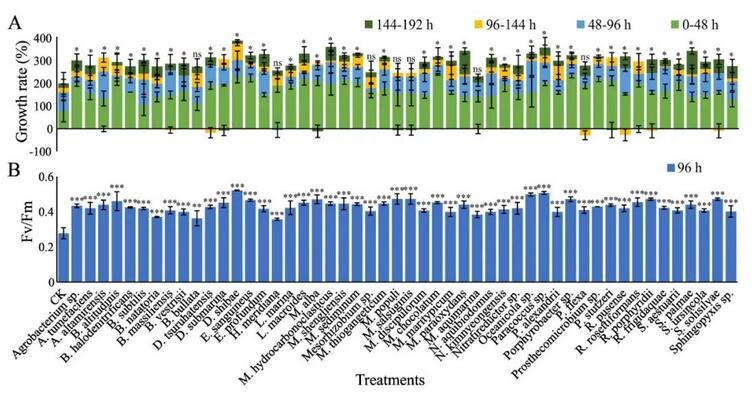
图2.AHN11与共生细菌的二元培养。(A)通过细胞密度变化计算的相对生长率。(B)96小时微藻Fv/Fm。横坐标表示添加菌株;CK是无菌微藻培养物。处理组和对照组在第192小时的生长速率差异:无差异(ns),P<;0.05(*),P<;0.01(**)。
2.2、在缺铁条件下
铁是光合作用和呼吸作用的重要元素。本研究分离的12株产铁载体细菌分别与AHN11在缺铁培养基中共培养(图3),同时,以一株不产生铁载体的MGPB菌株R.porphyridii作为对照。由于铁的限制,AHN11的生长速率和Fv/Fm均受到抑制。当AHN11与MGPB共培养时,12株产铁载体细菌中有6株能够促进微藻在缺铁培养基中的生长(P<;0.5),且添加D.shibea能使微藻获得最高的生长速率和Fv/Fm。尽管B.vestrisii、H.meridiana、B.altitudinis、A.tumefaciens、D.tsuruhatensis和B.massiliensis都具有铁载体活性,但它们在缺铁条件下对微藻生长没有影响。不产生铁载体的MGPB菌株R.porphyridii在这种缺铁条件下对微藻生长也没有促进作用。因此,并非所有产铁载体的细菌都能在缺铁时促进微藻生长,这可能与细菌释放铁载体的类型或含量不同有关。
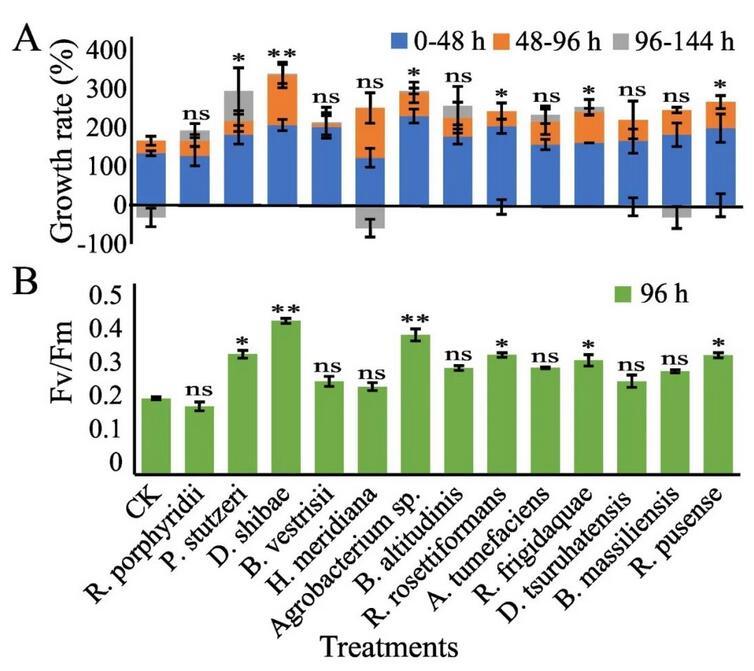
图3.AHN11与假定产铁载体细菌在缺铁培养基中的二元培养物。(A)通过细胞密度变化计算的相对生长率。(B)第96小时测定的微藻Fv/Fm。与实验对照组进行比较的差异:无差异(ns),P<;0.5(*),P<;0.1(**),P<;0.01(**)。
2.3、在高盐条件下
从分离的细菌中随机选取6株MGPBs,与无菌小球藻AHN11在高盐培养基中进行二元培养。随着盐度的增加,纯培养物的生长速率降低,而与细菌共培养时生长速率提高(图4)。除P.stutzeri外,与盐度为30时相比,MGPB对微藻生长的促进作用在盐度为45时增强,在盐度为60时减弱。当微藻与P.stutzeri共培养时,与盐度为30时相比,盐度为45时生长促进效应减弱,盐度为60时生长促进效应增强,这表明在较高盐度下,P.stutzeri提高微藻耐盐性的能力最强。P.stutzeri是一种常见的植物促生细菌(PGPB),广泛应用于改善植物在递增盐度梯度下的生长。而在微藻中,影响其盐度适应的驱动因素是微藻-细菌相互作用,即特定微生物的存在改变了微藻的盐适应性,这可能归因于细菌分泌的耐盐酶。在所有盐度下,所有二元培养液的Fv/Fm均极显著高于AHN11单培养液(P<;0.1)(图4B),进一步证明了MGPB能够缓解小球藻的盐胁迫。
在上述所有条件下,D.shibea对微藻的生长促进作用最好。D.shibea是玫瑰杆菌分支的一员,最初从鞭毛藻中分离出来,并已被证明是一种普遍存在的海洋微藻共生体。研究发现,D.shibea可以分泌多种外生代谢物,包括B族维生素前体和生长因子,这可能有利于微藻的生长。此外,代谢组学分析显示,当与D.shibea共培养时,假微型海链藻(Thalassiosira pseudonana)细胞中的多种氨基酸、脂肪酸和C4糖的表达均有上调。本研究已经证实D.shibea具有铁载体、ACC脱氨酶活性和固氮作用,有助于微藻利用不溶性铁、N2和降解ACC(乙烯的前体),从而促进微藻生长。56631669418228138
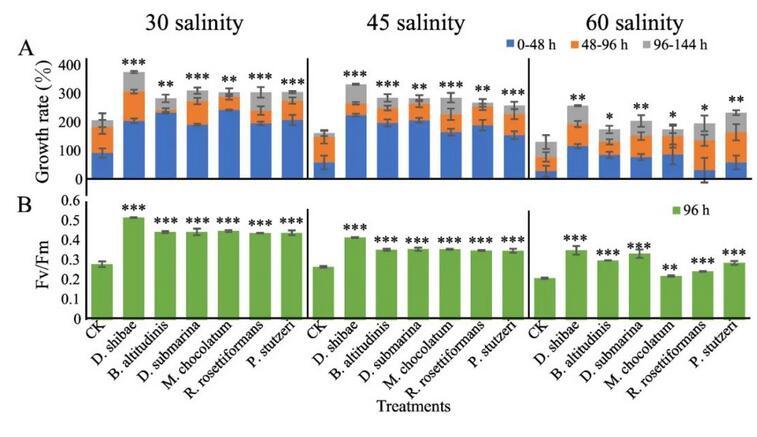
图4.不同盐度下的AHN11。(A)通过细胞密度变化计算的相对生长率。(B)第96小时微藻Fv/Fm。与对照组相比的差异:P<;0.5(*),P<;0.1(**),P<;0.01(**)。
3、MPGB与无菌小球藻在天然海水中的共培养
3.1、MPGB对小球藻生长的影响
使用两种天然海水(S和Q)配制宁波3号培养基。培养96 h后,微藻细胞密度差异显著(图5)。AHN11在S-海水(S)、无菌S-海水(S-)、添加混合细菌的S-海水(S+M)或无菌Q-海水(Q-)中几乎不生长。环境中的细菌可能是影响微藻生长的主要因素,因为无机养分在这些培养基中是充足的,非生物环境因素(如pH和盐度)也是有利的。只有当D.shibae被添加到S-海水(S+D)中时,无菌小球藻才能像在添加了D.shibae的Q-海水(Q+D)中一样生长旺盛。小球藻在未灭菌的Q-海水(Q)中生长最好。然而,当添加D.shibae(Q+D)或混合细菌(Q+M)时,微藻细胞密度与未灭菌的Q-海水(Q)相比有所下降,但其Fv/Fm无统计学差异(P>;0.5)(图5)。结果表明,在微生物组成对微藻不利的环境中,添加有益细菌可以促进微藻的生长,但在有利的环境下可能无效。
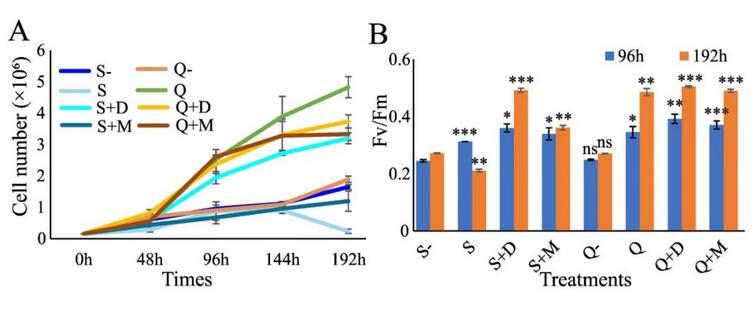
图5.AHN11在S或Q海水培养基中的生长。(A)微藻的生长。(B)微藻的Fv/Fm。S-&Q-:高压灭菌宁波3号S-或Q-海水。S&Q:宁波3号S-或Q-海水。S+D&Q+D:接种ANH11和D.shibae的宁波3号S-或Q-海水。S+M&Q+M:接种ANH11和混合细菌的宁波3号S-或Q-海水。与对照组相比,在实验结束时标记差异:P<;0.5(*),P<;0.1(**),P<;0.01(**)。
3.2、添加MPGB对小球藻藻际微生物的影响
为了证实上述假设,通过高通量测序进一步分析了处理之间的细菌群落组成。五个样品共获得1,071,093个16S rRNA基因序列,去除低质量序列后,每个样品平均获得63,202个reads,并用于后续分析。共获得细菌操作分类单元(OTUs)3639个,注释为518个属,注释率为85.47%。
3.3、海水和藻际微生物组的多样性
Chao1和Shannon指数分别表示样品中OTU的数量和群落多样性。如图6A所示,Q-海水(QA)或添加了D.shibae的Q-海水(QAD)中藻际细菌的多样性均显著高于Q-海水中原生细菌的多样性(Q)。在添加了D.shibae的S-海水(SAD)中,藻际微生物的多样性显著低于Q-海水中原生细菌的多样性(Q),但与S-海水中原生细菌的多样性(S)差异不显著。而在S-海水中,由于生物量低,无法检测到藻际微生物。这表明小球藻在Q-海水中可以招募更多的藻际微生物,而在添加有D.shibae的S-海水中可能只招募有利于其生长的微生物。PCoA反映了样本间的群落组成关系,距离越近,样本间的群落组成越相似(图6B)。在三种环境(QA、QAD和SAD)中,藻际微生物组成是聚集的。这表明,虽然SAD中的藻际微生物多样性较低,但物种组成与QA和QAD相似,尽管LEfSe(线性判别分析效应大小)和Venn图显示了它们之间的差异(图6C)。
LEfSe(图6C左)揭示了在丰度上存在显著差异的物种,Venn图(图6C右)总结了共有或特有物种之间的联系。在QAD和QA中发现了较为丰富的优势种(如QA中的Bacteroides和Roseivvirga,以及QAD中的Parasegetibacter和Lewinella),这表明微藻促生菌D.shibae的添加在改变藻际微生物的原始平衡中发挥了关键作用。
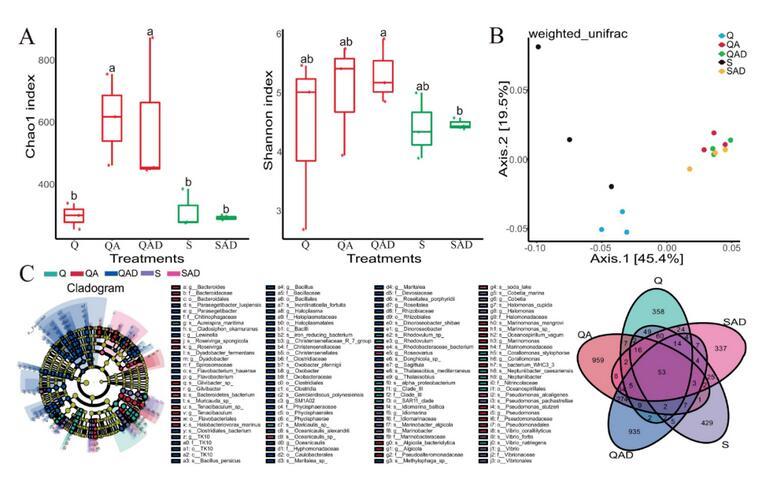
图6.细菌组成差异。(A)α-多样性。(B)β-多样性。(C)海洋样本中的共有物种和特有物种。S&Q:S-或Q-海水中的细菌组成。QA:宁波3号Q-海水中培养的藻际细菌组成。SAD&QAD:在添加有D.shibae的宁波3号S-或Q-海水中培养的藻际细菌组成。
3.4、海水和藻际微生物组的组成
变形菌门(Proteobacteria)是所有五个样本中的优势门,占OTU序列总数的87.17%±3.41%。与海水原生菌群相比,藻际积累了更多的α-变形菌(Alpha-Proteobacteria),而γ-变形菌(Gamma-Proteobacteria)的相对丰度降低(图7A)。在更高的分类学水平上(科或属水平),组成细菌分类群的相对贡献因样品而异(图7B,C)。然而,优势细菌分类群的组成也有明显的相似性。鲁杰氏菌属(Ruegeria)在两种海水中的相对丰度较低,但在藻际中富集。相比之下,在海水中相对丰度较高的交替单胞菌属(Alteromonas)、弧菌属(Vibrio)和Corallomonas是藻际中的稀有类群。这表明微藻能够选择性地招募特定菌群,并抑制弧菌科(Vibrionaceae)等病原菌的生长。正如Mars Brisbin等人的研究显示,细菌和微藻之间存在特定的有益相互作用,这些相互作用由确定性的群落组装稳态系统组装而成。Nitrincolaceae和红杆菌科(Rhodobacteraceae)是Q海水中的优势细菌,相对丰度分别为35.98%和18.69%。其中隶属于Nitrincolaceae的Corallomonas sp.相对丰度最高,为30.74%。在QA中,Rhodobacteraceae和假单胞菌科(Pseudomonadaceae)在藻际中的相对丰度显著增加。假单胞菌属(Pseudomonas)的相对丰度达到25.91%,而属于Rhodobacteraceae的Ruegeria相对丰度达到13.08%。据报道,红杆菌对浮游植物有益,其相对丰度与叶绿素A浓度呈正相关,这可以解释其在藻际中的富集现象。假单胞菌是常见的植物促生长细菌(PGPB),对微藻的生长也有促进作用。S-海水中的原生菌群由以Alteromonas和Vibrio为代表的交替单胞菌科(Alteromonadaceae)和弧菌科(Vibrionaceae)构成。Alteromonas是一种常见的微藻致死细菌,可分泌微藻细胞裂解液(β-葡萄糖苷酶),并通过碳输入实现快速生长。Vibrio可以利用微藻分泌的内源性色氨酸合成并分泌荧光素,进而合成IAA,破坏微藻细胞膜,加速微藻细胞裂解。这可能是小球藻在这种海水培养基中难以生长的原因。
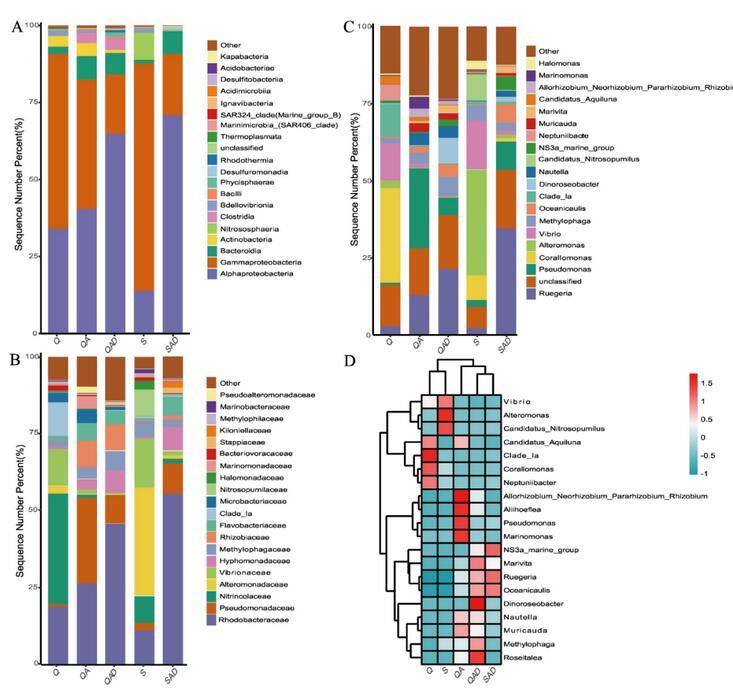
图7.细菌组成。(A)纲水平上样本OTU的分布。(B)科水平上样本OTU的分布。(C)属水平上样本OTU的分布。(D)属水平上样本细菌群落组成。S&Q:S-或Q-海水中的细菌组成。QA:宁波3号Q-海水中培养的藻际细菌组成。SAD&QAD:在添加有D.shibae的宁波3号S-或Q-海水中培养的藻际细菌组成。
3.5、细菌分类群与D.shibae添加之间的关联
在宁波Q-海水培养物中接入少量的D.shibae后,微藻生长下降(图5)。在QAD中,Rhodobacteraceae的相对丰度增加,Ruegeria的相对丰度达到21.41%,而Pseudomonadaceae的相对丰度下降。这可能归因于群体感应(QS)和群体淬灭机制,它们破坏了藻际微生物的平衡,影响了微藻的生长。D.shibae和Ruegeria是玫瑰杆菌分支的成员,释放与玫瑰杆菌鞭毛形成和运动相关的酰基高丝氨酸内酯QS。它可以防止玫瑰杆菌在拥挤和潜在有限的微环境中聚集,并促进其在宿主中更均匀的定殖。我们推测,D.shibae的加入将导致培养物中QS的含量增加,并促进更多Ruegeria和D.shibae定殖(图7C)。玫瑰杆菌分支成员也被发现通过产生抑制性化合物和采用扩散性杀伤机制来抑制或杀死其竞争对手,这也可能是由QS诱导的。研究发现Ruegeria可杀死Vibrio,并对Pseudomonas有一定的抑制作用。这可能是藻际中Pseudomonas减少的原因。此外,细菌的引入还引起了其他变化,例如在QA中发现了Kiloniellaceae,但在QAD中没有。热图聚类分析(图7D)显示,QAD的微生物组成与SAD更相似(QAD和SAD首先聚在一起,然后与QA聚在一起)。Rhodobacteraceae在藻际中显著富集,相对丰度从S-海水中的11.04%增加到55.61%(其中Ruegeria占34.4%),而Pseudomonadaceae的相对丰度略低,从S-海水中的2.47%增加到9.75%(其中Pseudomonas占9.03%)。相比之下,海水富集的有害细菌Alteromonadaceae和Vibrionaceae的相对丰度从S-海水藻际中的50.17%下降到1.2%(其中Alteromonas占1.18%)和1.41%(其中Vibrio占1.41%)。可能由于D.shibae释放的QS,有益细菌在藻际的定殖增加,同时环境中的有害细菌受到抑制,这使得小球藻能够在S-海水环境中生长。Ly等人的实验观察到了类似的结果,其中有益细菌减轻了环境强光对微藻的胁迫。本研究表明,添加MGPBs可以通过改变藻际微生物组促进小球藻在不利环境中的生长。目前对MGPBs的研究主要集中在微藻生物量和代谢物生产,以及收获和净化方面,而MGPB对藻际微生物组成的影响尚未见报道。以往关于藻际微生物组的研究主要集中在有害细菌上。例如,添加具有杀藻活性的有害细菌会降低藻际微生物的多样性,使更多添加的有害细菌和更少的Rhodobacteraceae在藻际中定殖,导致微藻大量裂解死亡。这些结果表明,引入D.shibae可以改变藻际微生物的组成。
结论
利用细菌来促进微藻的生长和代谢是一种很有前景的生物技术应用方法。本实验从4种小球藻中分离出50株共生细菌,其中86%为微藻促生菌(MGPB)。MGPB对微藻的生长有一定影响,可以提高微藻的抗逆性。此外,还获得了一株高效MGPB菌株D.shibae。接种D.shibae可以改变小球藻藻际微生物组的组成,使其招募更多的Rhodobacteraceae和更少的Pseudomonadaceae。这一方法能在不利微生物环境中促进小球藻的生长,但在有利环境中则会降低小球藻的生长。本研究为MGPB在不利环境中促进建立微藻群落补充了新的应用。
相关新闻推荐
1、大肠埃希菌、白色念珠菌、黑曲霉等5种标准菌生长曲线测定方法与经验分享