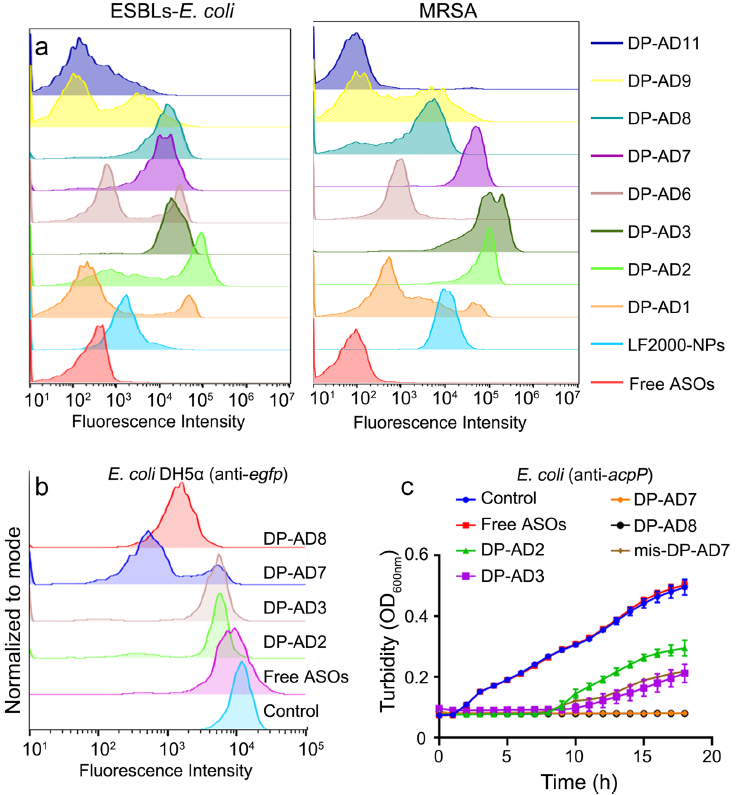
图2 、通过递送效率和体外反义效果筛选DP-AD。a在37℃避光条件下,与FAM标记的DP-AD孵育1小时后,通过流式细胞术检测产ESBLs大肠杆菌(左)和MRSA(右)的FAM阳性比率。游离的FAM标记ASOs(红色)和LF2000-NPs(浅蓝色)分别用作阴性和阳性对照。b与1 μM DP-ADanti-egfp孵育3小时后,通过流式细胞术测量表达GFP的大肠杆菌(DH5α)的GFP荧光强度。c用不同两亲性DP-ADanti-acpP(1 μM)处理的产ESBLs大肠杆菌的生长曲线,OD600nm表示600 nm处的光密度。
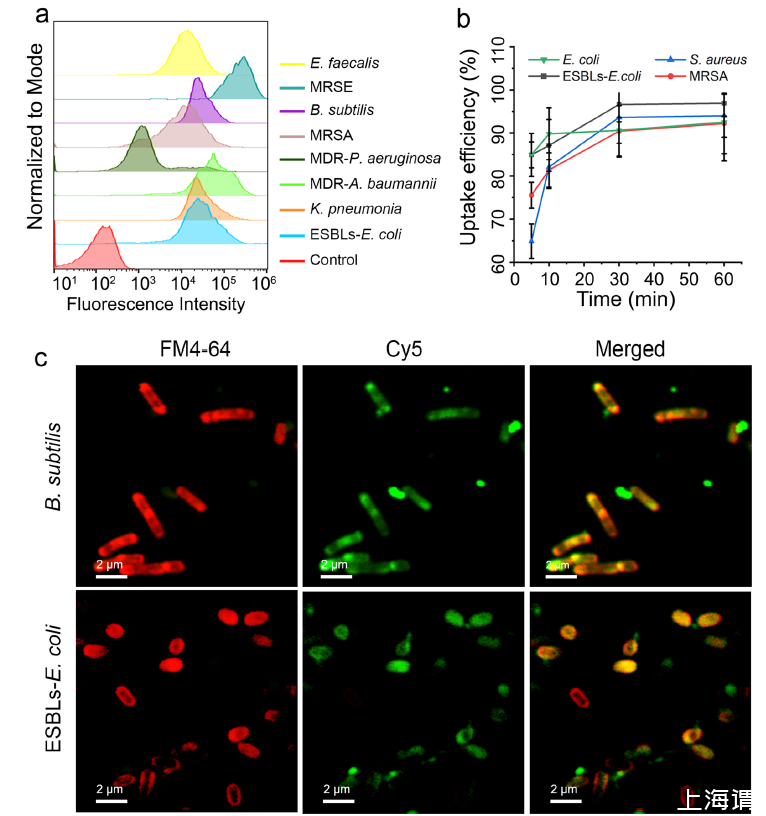
图3 、DP-AD7的摄取谱。a 流式细胞术测量产ESBLs大肠杆菌、肺炎克雷伯菌、MDR鲍曼不动杆菌、MDR铜绿假单胞菌、MRSA、枯草芽孢杆菌、MRSE和粪肠球菌在避光条件下与1 μM FAM标记的DP-AD7孵育1小时后的荧光阳性比率。b 37℃避光条件下,与FAM标记的DP-AD7孵育5、10、30和60分钟后,通过流式细胞术测量的测试菌株的FAM阳性率。c 37℃避光条件下与cy5标记的DP-AD7孵育1小时后,产ESBLs大肠杆菌(上图)和枯草芽孢杆菌(下图)的CLSM图像。使用FM4-64染色细菌细胞膜。标尺=2μm。
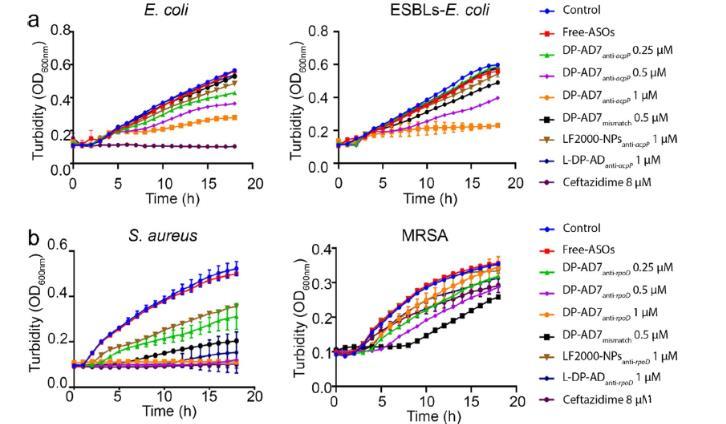
图4 、DP-AD7的体外抗菌活性。a DP-AD7 anti-acpP对大肠杆菌(左)和产ESBLs大肠杆菌(右)的生长抑制。b DP-AD7 anti-rpoD对金黄色葡萄球菌(左)和MRSA(右)的生长抑制。头孢他啶和LF2000-NPs anti-acpP用作阳性对照,游离ASOs和L-DP-AD用作阴性对照。OD600nm表示600 nm处的光密度。
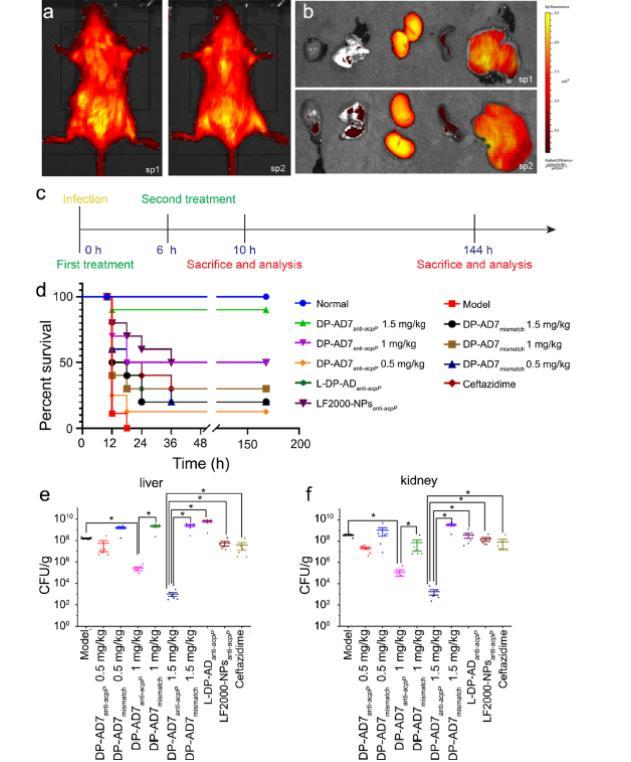
图5、 DP-AD7 anti-acpP对脓毒症模型中产ESBLs大肠杆菌的抗菌活性。a, b 通过活体成像系统测定DP-AD7 anti-acpP在小鼠体内的生物分布。小鼠腹腔注射400 μl cy5标记的DP-AD7。注射2小时后,在活体小鼠(a)或收集的小鼠器官(b)中检测荧光信号。sp1和sp2是两个独立样本。c 体内实验的治疗和分析程序示意图。d 用DP-AD7 anti-acpP(1.5, 1和0.5 mg/kg)、DP-AD7 mismatch(1.5, 1或0.5 mg/kg)或L-DP-AD anti-acpP(1.5 mg/kg)处理的BalB/c小鼠的存活率(n = 10)。LF2000-NPs anti-acpP(1.5 mg/kg)和头孢他啶(4 mg/kg)用作阳性对照。e, f 产ESBLs大肠杆菌接种物在肝脏(e)和肾脏(f)中的定植情况。数据代表平均值±标准误(n = 6)。*p<0.05。
总结
由多重耐药(MDR)细菌,尤其是革兰氏阴性菌引起的感染暴发,已成为医院和社区面临的全球性健康问题。基于反义寡核苷酸(ASOs)的治疗方法在治疗MDR细菌引起的感染方面具有巨大前景。然而由于其高分子量和亲水性导致的低细胞穿透效率,ASOs疗法受到了阻碍。研究人员设计了一系列树突状多肽(DPP1至DPP12)来包裹ASOs,形成DSPE-mPEG 2000修饰的ASOs/DPP纳米颗粒(DP-AD1至DP-AD12),并观察到具有正电荷数≥8的两亲性DP-AD2、3、7或8能够高效地将ASOs递送入细菌,但只有含有两个组氨酸残基的DP-AD7和DP-AD8在体外能显著抑制测试细菌的生长及其靶基因的表达。靶向acpP的DP-AD7显著提高了被产ESBLs大肠杆菌感染的脓毒症小鼠的存活率,在体内表现出强大的抗菌效果。本研究首次设计DPP作为递送ASOs以对抗MDR细菌的有效载体,并阐明了高效DPP递送所需的基本特征,即两亲性、8-10个正电荷以及2个组氨酸残基,为反义抗菌策略的研发提供了一种新方法。BioScreen C全自动生长曲线分析仪作为核心实验工具,为本研究提供了精准、可重复的细菌生长量化数据,直接支撑了DP-AD递送系统高效性的结论。其自动化特性不仅提高了实验效率,还确保了数据在评估新型抗菌策略中的科学严谨性,为antisense技术对抗MDR细菌的应用研究奠定了方法学基础。
相关新闻推荐
1、米酒酿造过程酿酒酵母与异常汉逊酵母的相互作用及工艺优化研究
2、大肠埃希氏菌衰亡期再次接种菌种和补加乳糖可提高岩藻糖基乳糖产量
