研究简介
随着多药耐药(MDR)细菌感染的全球蔓延,尤其是革兰氏阴性菌,传统抗生素疗法面临严峻挑战。反义寡核苷酸(ASOs)技术通过靶向抑制关键基因(如耐药基因或生存必需基因),展现出精准抗菌潜力。然而,ASOs 因分子量大、亲水性强,难以穿透细菌细胞膜,其临床应用受阻。本研究旨在设计一种新型树枝状多肽(DPP)载体,通过非共价包裹 ASOs 形成纳米颗粒(DP-AD),以高效递送 ASOs 对抗 MDR 细菌,并在体外和体内验证其有效性。研究人员合成了 12 种 DPP(DPP1-DPP12),通过调控疏水性、正电荷分布(如精氨酸和赖氨酸)及氨基酸类型(如引入组氨酸),系统评估影响递送效率的关键因素。ASOs 与 DPP 通过静电作用形成纳米颗粒(AD),再经 DSPE-mPEG2000 修饰获得稳定的 DP-AD。通过透射电镜(TEM)、动态光散射(DLS)和凝胶电泳表征颗粒形态、粒径(约 130-150 nm)和封装率(>85%)。筛选条件包括两亲性、正电荷数≥8 及组氨酸残基的存在。在小鼠败血症模型中,单次腹腔注射 DP-AD7anti-acpP(1.5 mg/kg)可使感染 ESBLs-E. coli 的小鼠生存率提升至 90%,显著高于对照组(如 LF2000-NPs 生存率 50%)。组织分布显示纳米颗粒主要富集于肝、肾,并显著降低细菌载量。病理学分析证实 DP-AD7 能减轻器官损伤,且无显著溶血或细胞毒性。本研究首次明确 DPP 载体递送 ASOs 的关键特征,两亲性、8-10 个正电荷及两个组氨酸残基。DP-AD 平台兼具高负载、低毒性和广谱抗菌潜力,为克服 MDR 细菌感染提供了新型非共价递送策略。
Bioscreen 全自动生长曲线分析仪的应用
将LB中的大肠杆菌溶液在4℃以2500 g离心5分钟,用M-H肉汤重悬。将细菌溶液(10^6 CFU,溶于300 μl M-H肉汤)与300 μl DP-AD anti-acpP(用于大肠杆菌和产ESBLs大肠杆菌)或DP-AD anti-rpoD(用于金黄色葡萄球菌或MRSA)溶液混合。将混合物分装到培养板的三个孔中,置于BioScreen C全自动生长曲线分析仪中,37℃孵育18小时,每小时测量光密度。数据使用Graphpad Prism绘图和分析。
实验结果
设计了一系列具有不同疏水性、正电荷分布模式和氨基酸类型的DPPs,并制备了一种新型的非共价DP-AD。研究发现DPPs中的羟基和正电荷数少于8会干扰NPs的形成。正电荷的集中分布有利于DP-AD的递送,而平均分布则会阻碍这一过程。两亲性DPP2、DPP3、DPP7和DPP8显示出显著更高的效率将ASOs递送至革兰氏阴性和革兰氏阳性细菌,而只有序列中含有两个His残基的两亲性DPP7和DPP8在体外表现出最佳的反义抑制效率。重要的是,DP-AD7 anti-acpP在产ESBLs大肠杆菌感染的小鼠中表现出优异的抗菌活性。基于这些结果,具有8-12个正电荷的DPPs的亲水性末端有利于与ASOs复合。疏水性末端通过加强其与富含脂质的质膜的相互作用,促进DPPs进入细菌,而DPPs中的两个His残基则促进负载的药物在细菌胞质内的释放。首次确定了影响DP-AD形成和细菌中转染效率的关键因素,并为反义抗菌策略的进一步研究和应用提供了一种新方法。
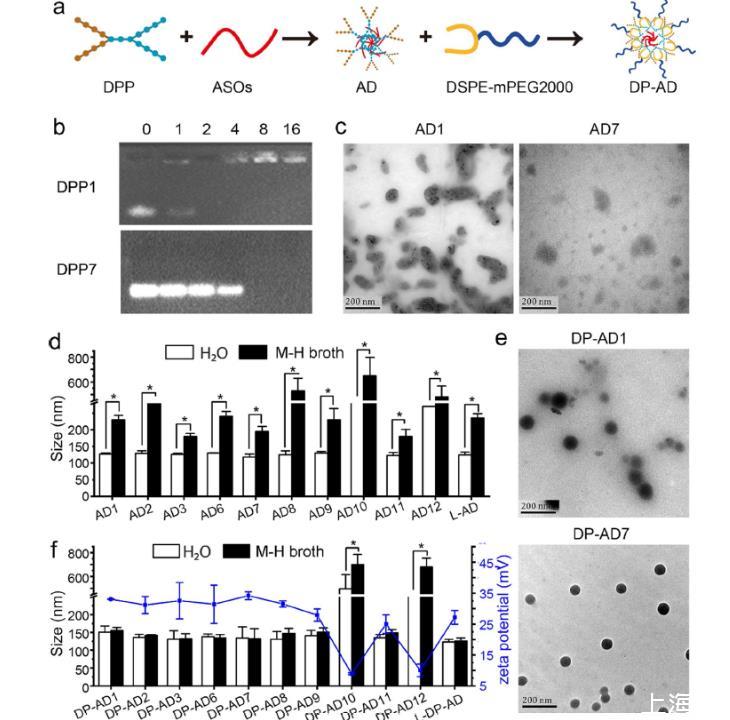
图1、 DP-AD7 anti-acpP对脓毒症模型中产ESBLs大肠杆菌的抗菌活性。a, b 通过活体成像系统测定DP-AD7 anti-acpP在小鼠体内的生物分布。小鼠腹腔注射400 μl cy5标记的DP-AD7。注射2小时后,在活体小鼠(a)或收集的小鼠器官(b)中检测荧光信号。sp1和sp2是两个独立样本。c 体内实验的治疗和分析程序示意图。d 用DP-AD7 anti-acpP(1.5, 1和0.5 mg/kg)、DP-AD7 mismatch(1.5, 1或0.5 mg/kg)或L-DP-AD anti-acpP(1.5 mg/kg)处理的BalB/c小鼠的存活率(n = 10)。LF2000-NPs anti-acpP(1.5 mg/kg)和头孢他啶(4 mg/kg)用作阳性对照。e, f 产ESBLs大肠杆菌接种物在肝脏(e)和肾脏(f)中的定植情况。数据代表平均值±标准误(n = 6)。*p<0.05。
相关新闻推荐
1、不同酵母的生长曲线、发酵力、耐冻性能测定及发酵面团感官评定(一)
3、巴西孢子丝菌体内毒力、生长曲线、对氧化剂敏感性及抗真菌药敏试验(三)
