近十年来,我国鳗鲡养殖发展迅速。鳗鲡一般养殖密度大,一旦受病害,往往给养殖者造成巨大的经济损失。鳗鲡常见疾病源主要有细菌、真菌、寄生虫及其病毒等,其中以细菌性疾病危害最为严重。据报道[1-5],鳗鲡细菌性疾病的病源以气单胞菌、假单胞菌、鳗弧菌、爱德华氏菌与柱状屈桡杆菌为主,如引起鳗鲡烂腮病的气单胞菌、柱状屈桡杆菌,引起鳗鲡败血症的气单胞菌、假单胞菌,引起鳗鲡红点病与肝肾病的爱德华氏菌等。
针对鳗鲡细菌性疾病的预防或治疗,多数采用化学制剂类、抗生素类药物[3-6],该类药物不仅对环境造成一定的污染,还可能破坏鱼类肠道正常菌群平衡,导致药物残留和造成病原微生物产生耐药性等。根据农业农村部第194号公告,2020年起饲料添加剂禁止添加抗生素,养殖户应减少或限制抗生素使用,从而减少抗生素在环境、安全健康、耐药性等方面产生的负面影响,养殖行业必将朝着减抗替抗的趋势发展。
益生菌是一种有利于宿主健康的微生物,其优点是具有与抗生素一样的抗菌活性,无抗生素所带来的副作用,同时具有促进鱼类食欲、提高饲料利用率、加快鱼类生长、提高鱼类机体免疫力以及改良养殖环境等特点,是抗生素的重要替代品[7]。益生菌主要包括乳酸菌与芽孢杆菌,乳酸菌能够调节水质和鱼类肠道菌群平衡,产生抗菌物质,抑制有害菌的生长,且能定植肠道[8-11]。芽孢杆菌既能产生多种酶类,帮助动物对营养物质进行消化吸收,还能有效分解有机质,去除氨氮、硫化氢,达到水质改良的目的[12-15]。然而,益生菌制剂在鳗鲡养殖中的运用鲜有报道,说明将益生菌运用于鳗鲡养殖还有很大的研究空间。
现从鳗鲡肠道分离出具有抑制鳗鲡病原菌、且能调节水质环境的多株益生菌,对菌株的安全性进行研究,从而获得鳗鲡肠道内源性益生菌,为后续研发复合益生菌制剂并运用在鳗鲡养殖过程中奠定基础,为鳗鲡安全、环保养殖新增一条可持续发展道路。
1研究方法
1.1材料与试剂
(1)鳗鲡。体质量约150 g的健康鳗鲡购自福建某鳗鲡养殖场。
(2)培养基配方。氨氮及亚硝酸盐降解能力测定培养基[16]:葡萄糖10.0 g、硫酸铵[(NH4)2S04]0.25 g、亚硝酸钾(KNO2)0.15 g、氯化钠(NaCl)1.0 g、硫酸镁(MgSO4)·7水(H2O)1.0 g、磷酸钾(K2HPO4)1.0 g、水1L、pH值7.2~7.4。1×105Pa灭菌15 min。
1.2试验方法
(1)鳗鲡肠道内源性益生菌分离及鉴定。将鳗鲡肠道纵向剪开,用磷酸盐缓冲液(pH值7.0)冲洗去除肠道中粪便污水等内容物,后剪碎,加入少量无菌生理盐水震荡混匀,再以10倍梯度稀释至10-4,分别吸取0.1 mL涂布平板培养基,采用MRS厌氧培养,80℃水浴加热10 min,后涂布营养琼脂、涂布添加氯霉素的YPD培养基的方法分离乳酸菌、芽孢杆菌与酵母菌。30℃培养3 d,挑取单菌落,划线纯化,直至得到纯的单菌落。采用16S rRNA细菌通用引物[17]进行扩增,正向引物为27F:5’-GAGAGTTTGA TCCTGGCTCAG-3’,反向引物为1492R:5'-TACGGCTAC CTTGTTACGAC-3’,测序由北京睿博兴科生物技术有限公司完成。所得序列经过NCBI(美国生物技术信息中心)数据库的BLAST进行在线同源性比对。
(2)菌株对鳗鲡致病菌抑菌试验。将菌株接种于相应液体培养基,培养24 h,备用。用接种环分别挑取7株病原菌菌泥,加入无菌生理盐水中,混匀,使菌终浓度为107CFU/mL,得到指示菌菌悬液,置4℃冰箱备用。取1 mL指示菌悬液,加入50℃采用海水配置的营养琼脂100 mL,待冷却凝固后将牛津杯置于平板中,往牛津杯中加入0.20 mL益生菌培养液,置于30℃下培养48 h,观察有无抑菌圈产生,并用游标卡尺测量抑菌圈直径。
(3)菌株对氨氮及亚硝酸盐的降解能力测定试验。将菌株接种于相应液体培养基,28℃、120 r/min恒温摇床震荡培养24 h,4℃、4 000 r/min离心10 min,弃上清液,细菌沉淀用生理盐水清洗3次,收集菌泥,并用无菌生理盐水稀释成终浓度为108CFU/mL的菌悬液,备用。
按1%(V/V)接种量,将菌悬液接入氨氮与亚硝酸盐降解能力测定培养基,28℃,120 r/min恒温摇床震荡培养,每隔8 h取样检测氨氮与亚硝酸盐含量、OD600nm处吸光度。将菌悬液替换成无菌生理盐水做为空白对照组。采用《水质亚硝酸盐氮的测定分光光度法》(GB 7493—1987)测定培养液中亚硝酸盐含量,《水质铵的测定纳氏试剂比色法》(GB 7479—1987)测定培养液中氨氮含量。
(4)菌株药物敏感性试验。将菌株接种于相应液体培养基,30℃、120 r/min恒温摇床震荡培养24 h,4℃、4 000 r/min离心10 min,弃上清液,细菌沉淀用生理盐水清洗3次,收集菌泥,并用无菌生理盐水稀释成终浓度108CFU/mL的菌悬液,备用。吸取1 mL活菌数约108CFU的菌液,各加入相应的琼脂培养基(50℃)中,混合均匀后倾注倒入灭菌培养皿中,冷却凝固后贴上药敏纸片,静置15 min后,将平皿置于30℃恒温培养箱中培养24 h,观察并测量抑菌圈直径。
(5)菌株安全性试验。溶血试验:将活化后的菌株接种于相应的液体培养基,28℃、120 r/min恒温培养24 h。采用无菌生理盐水10倍递增稀释至10-5,吸取0.1 mL稀释菌液至5%兔血营养(或MRS)琼脂培养基,涂布均匀。28℃恒温培养48 h后观察有无溶血圈。鱼种毒性试验:将各自培养24 h的发酵菌液10 L,经过4 000 r/min离心10 min后,收集菌体。将菌加到鳗鲡养殖缸(100 cm×55 cm×50 cm)中,使得水体含菌终浓度约108CFU/mL,每缸养殖健康鳗鲡10尾,试验时间15 d。试验期间,缸内不充氧、不换水,正常喂食,每天观察鱼的活动及健康情况,试验结束后,剖检器官。
(6)数据分析与处理。试验均为3个平行,采用Microsoft Excel和SPSS软件对数据进行分析与处理。
2结果与分析
2.1鳗鲡肠道内源性益生菌分离及鉴定
采用鳗鲡肠道分离菌株,将肠道处理液10倍梯度稀释至10-4,吸取0.1 mL涂布定向分离益生菌,去除绝大部分低活菌与在肠道非优势的菌株,从而获得鳗鲡肠道优势且能定植的内源性菌株。通过筛选分离得到7株菌株,分别为芽孢杆菌B1、B2、B3与乳酸菌L1、L2、L3与L4。经16S rRNA测序所获得的基因序列,通过NCBI网址采用BLAST软件进行菌株同源性比对,L1菌株与屎肠球菌Enterococcus faeciumSP32的核苷酸系列同源性为100%,L2菌株与植物乳杆菌Lactobacillus plantarum1860的核苷酸系列同源性为99.93%,L3菌株与蜡状芽孢杆菌Bacillus cereusGT-5的核苷酸系列同源性为100%,L4菌株与鼠李糖乳杆菌Lactobacillus rhamnosus3033的核苷酸系列同源性为100%,B1菌株与地衣芽孢杆菌Bacillus licheniformisPZ-54的核苷酸系列同源性为100%,B2菌株与枯草芽孢杆菌Bacillus subtilisHN-2的核苷酸系列同源性为100%,B3菌株与蜡状芽孢杆菌Bacillus cereusGT-5的核苷酸系列同源性为100%。
在菌株安全方面有报道[18-20],显示蜡状芽孢杆菌能产生多种毒素,导致腹泻或呕吐型食物中毒,是食物常见的污染菌。而屎肠球菌在近年的研究中证实为严重的条件致病菌,在适宜条件下,会引发疾病,而耐药性的屎肠球菌更是具有潜在的危害性[21]。因此在2012年国际益生菌协会(IPA)和世界卫生组织(WHO)均建议益生菌中不宜使用屎肠球菌。故选取在安全上较无争议的植物乳杆菌L2、鼠李糖乳杆菌L4、地衣芽孢杆菌B1与枯草芽孢杆菌B2作为研究对象,做进一步的菌株特性研究。
2.2菌株对鳗鲡致病菌抑菌试验
将分别培养24 h的L2、L4、B1与B2菌株发酵液对7种水产常见病原菌进行抑制试验。结果表明,4株菌株对7种病原菌均表现出一定程度的抑制效果,其中L2、L4对大肠杆菌与沙门氏菌表现出高敏感,对3株弧菌与2株单胞菌表现出极敏感。而B1、B2对大肠杆菌与沙门氏菌表现出低敏感,对3株弧菌与2株单胞菌表现出高敏感,且乳酸菌L2、L4的抑菌效果优于芽孢杆菌B1、B2,具体试验结果与抑菌效果见表1。
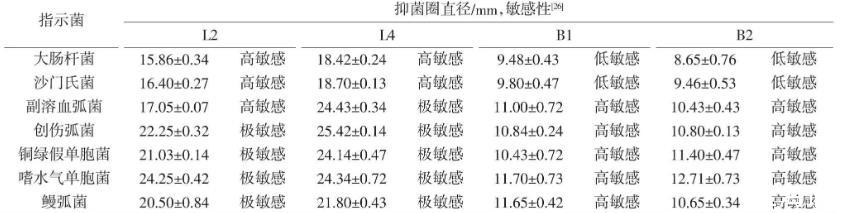
表1 4株益生菌对病原菌的抑菌效果①
有研究表明[22-23],乳酸菌主要是代谢产生有机酸及其他具有抑菌活性的物质进行抑菌。而枯草芽孢杆菌[24-25]与地衣芽孢杆菌也能产生抗菌肽从而达到抑菌效果。虽然乳酸菌与芽孢杆菌都能产生抗菌物质,但不同的菌株所产生的抗菌肽在数量和种类上也是各不相同,这也是不同菌株抑菌效果不同的主要原因之一。而该试验中乳酸菌L2、L4菌株的抑菌效果优于芽孢杆菌B1、B2,推测有可能就是因为乳酸菌产生的抗菌肽数量多于芽孢杆菌,而乳酸菌还能产生有机酸,进一步抑制了有害菌的生长。
2.3菌株对氨氮及亚硝酸盐的降解能力测定试验
通过L2、L4、B1与B2菌株对氨氮、亚硝酸盐的降解能力测试试验,从而了解这4株菌株在养殖水改良方面的运用。在以硫酸铵作为唯一氮源的降解试验中,以50.15 mg/L作为起始质量浓度,经过菌株32 h发酵,扣除空白对照组的影响,其中L2降低至9.42 mg/L,降解率达81.22%;L4降低至7.25 mg/L,降解率达85.54%;B1降低至2.97 mg/L,降解率达94.08%;B2降低至4.66 mg/L,降解率达90.71%。其中L2、L4对氨氮的降解与B1、B2比对,差异显著(P<0.05)。在以亚硝酸钾作为唯一氮源的降解试验中,以92.42 mg/L为起始质量浓度,经过菌株32 h发酵,L2降低至33.48 mg/L,降解率达63.77%;L4降低至28.82 mg/L,降解率达68.82%;B1降低至1.09 mg/L,降解率达98.82%;B2降低至1.27 mg/L,降解率达98.63%。其中L2、L4对亚硝酸盐的降解与B1、B2比对,差异显著(P<0.05),B1与B2之间差异不显著(P>0.05)。乳酸菌L2、L4对氨氮的降解速率高于对亚硝酸盐的降解速率,达显著差异水平(P<0.05)。在氨氮与亚硝酸盐的降解发酵过程中,菌株OD值逐渐增加,且菌株OD600nm的变化与菌株对氨氮或亚硝酸盐的降解呈正相关,说明这4株菌株的生长代谢伴随着氨氮或亚硝酸盐的消耗。在空白对照组CK中,氨氮在32 h内降解0.98%,有可能是氨挥发导致的自然降解,而亚硝酸盐含量变化不大,具体试验结果见表2。
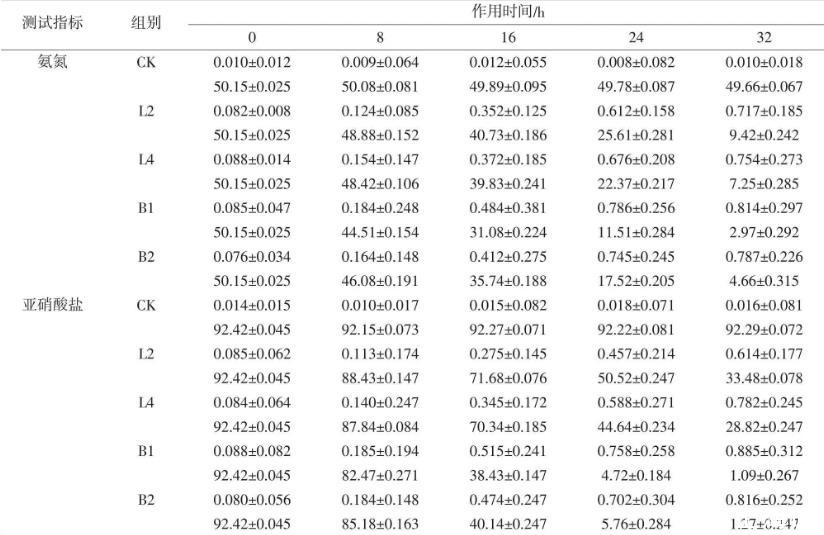
表2菌株OD600nm对氨氮、亚硝酸盐降解能力(n=3;±SD)mg/L
表2菌株OD600nm对氨氮、亚硝酸盐降解能力(n=3;±SD)mg/L
测试指标组别作用时间/h 0 8 16 24 32氨氮CK 0.010±0.012 0.009±0.064 0.012±0.055 0.008±0.082 0.010±0.018 50.15±0.025 50.08±0.081 49.89±0.095 49.78±0.087 49.66±0.067 L2 0.082±0.008 0.124±0.085 0.352±0.125 0.612±0.158 0.717±0.185 50.15±0.025 48.88±0.152 40.73±0.186 25.61±0.281 9.42±0.242 L4 0.088±0.014 0.154±0.147 0.372±0.185 0.676±0.208 0.754±0.273 50.15±0.025 48.42±0.106 39.83±0.241 22.37±0.217 7.25±0.285 B1 0.085±0.047 0.184±0.248 0.484±0.381 0.786±0.256 0.814±0.297 50.15±0.025 44.51±0.154 31.08±0.224 11.51±0.284 2.97±0.292 B2 0.076±0.034 0.164±0.148 0.412±0.275 0.745±0.245 0.787±0.226 50.15±0.025 46.08±0.191 35.74±0.188 17.52±0.205 4.66±0.315亚硝酸盐CK 0.014±0.015 0.010±0.017 0.015±0.082 0.018±0.071 0.016±0.081 92.42±0.045 92.15±0.073 92.27±0.071 92.22±0.081 92.29±0.072 L2 0.085±0.062 0.113±0.174 0.275±0.145 0.457±0.214 0.614±0.177 92.42±0.045 88.43±0.147 71.68±0.076 50.52±0.247 33.48±0.078 L4 0.084±0.064 0.140±0.247 0.345±0.172 0.588±0.271 0.782±0.245 92.42±0.045 87.84±0.084 70.34±0.185 44.64±0.234 28.82±0.247 B1 0.088±0.082 0.185±0.194 0.515±0.241 0.758±0.258 0.885±0.312 92.42±0.045 82.47±0.271 38.43±0.147 4.72±0.184 1.09±0.267 B2 0.080±0.056 0.184±0.148 0.474±0.247 0.702±0.304 0.816±0.252 92.42±0.045 85.18±0.163 40.14±0.247 5.76±0.284 1.27±0.247
2.4菌株药物敏感性试验
文献[27-28]表明,微生物菌群间能传递细菌耐药性的基因,从而使某种菌株获得耐药性,因此菌株在耐药性的问题上颇受关注。《水产动物饲用乳酸菌筛选标准》和《水产动物饲用芽孢杆菌筛选标准》规定,所筛选的菌株必须对水产动物和人类是无害的,且无抗生素耐药性及致病性。采用10种抗生素对L2、L4、B1与B2菌株进行药物敏感测试,结果表明,4株菌株对复方新诺明与诺氟沙星2种药物分别有一定程度的耐药性,而对青霉素、氯霉素、庆大霉素、四环素等8种药物表现敏感,检测结果见表3。
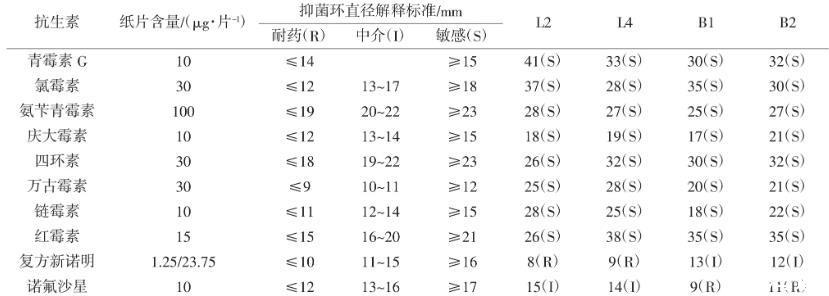
表3菌株对10种药敏纸片的敏感性
2.5菌株安全性试验
在溶血试验中,L2、L4、B1与B2菌株培养的5%兔血琼脂平板都无溶血环形成,将养殖水体的菌株活菌浓度提高至108CFU/mL,对10条鳗鲡观察15 d,其吃食、游动正常,未发现任何异常现象或死亡情况。剖检观察鳃丝、肝脏、肠道、胆囊、鳔、肾脏等器官均无明显病变情况。由此可见,L2、L4、B1与B2菌株在108CFU/mL浓度下对鳗鲡无害。
3结论
从鳗鲡肠道筛选获得肠道优势菌株4株,分别为地衣芽孢杆菌B1、枯草芽孢杆菌B2、植物乳杆菌L2与鼠李糖乳杆菌L4。在抑制鳗鲡病原菌试验中,4株菌株皆表现出抑制病原菌的能力,在水产养殖中,抑制弧菌的效果尤其显著。在以硫酸铵或亚硝酸钠作为唯一氮源时,28℃培养32 h后,这4株菌株皆表现出具备较强的降解氨氮与亚硝酸盐的能力。至于在菌株安全性上,这4株菌株对常见的青霉素、氯霉素、庆大霉素、四环素等8种药物表现敏感,无溶血现象,在菌浓度高达108CFU/mL时,对鳗鲡也是无害的。
试验表明,从鳗鲡肠道分离得到的益生菌,可抑制鳗鲡病原菌,且能调节水质环境,对鳗鲡无致病性,对常见抗生素无耐药性,符合《水产动物饲用乳酸菌筛选标准》和《水产动物饲用芽孢杆菌筛选标准》规定。对获得的鳗鲡肠道内源性益生菌进行菌株特性研究,为后续研发微生物制剂并运用于鳗鲡养殖奠定理论基础,为鳗鲡养殖提供一条安全、环保、可持续发展的道路。
相关新闻推荐
2、增温和二氧化碳富集对土壤细菌的生长策略、系统发育模式的影响(二)