结果与讨论
猪链球菌BirA蛋白是II组BPL成员
猪链球菌似乎是生物素营养缺陷型,因为它缺乏生物素合成,并依赖于BioY-BirA机制从栖息地和/或感染宿主环境中清除生物素(图1)。Rodionov等人的系统生物学表明,以大肠杆菌BirA为例的双功能BPL酶(II组)在真细菌和古细菌中普遍存在,暗示II组形式可能是BPL的祖先。与缺乏DNA结合结构域的I组BPL(例如,农杆菌和布鲁氏菌的BirA直系同源物)不同,多序列比对分析表明猪链球菌BirA与范例大肠杆菌birA产物大致相似(图2)。然而,在猪链球菌的近亲乳酸乳球菌中,情况似乎不寻常,因为这种益生菌含有两个版本的BPL,其中一个是指BirA1_LL(II组BPL),另一个是缺乏DNA相互作用基序的BirA2_LL(I组BPL)(图2)。
为了解决猪链球菌BirA的BPL生物化学问题,我们应用蛋白质工程来生产重组蛋白。正如预期,我们收获了质量约为37 kDa的BirA_ss蛋白(图3A)。此外,通过SDS-PAGE判断纯度(图3A)。为了进一步确认身份,将重组BirA蛋白消化的多肽片段进行MALDI-TOFF分析。MS结果表明重组蛋白与猪链球菌BirA的天然形式匹配良好,显示出54%的覆盖率(图3B)。结构建模将猪链球菌BirA指定为具有完美结构的典型II组BPL版本(图3C)。它包括以下三个功能基序:N端DNA结合结构域、中央结构域和C端结构域(图3C)。显然,上述数据将猪链球菌BirA定义为II组BPL成员。
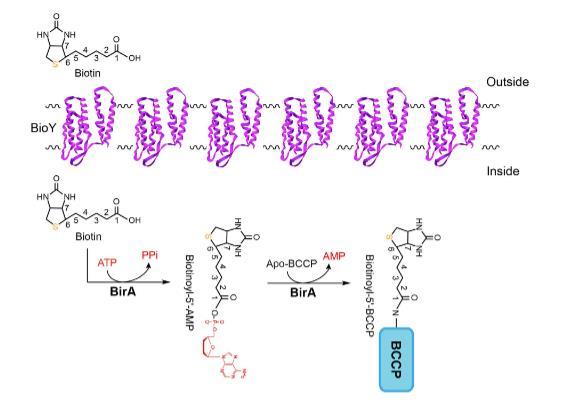
图1. 猪链球菌中生物素转运和利用的当前模型。生物素转运蛋白BioY用建模的带状结构(紫色)说明,并整合到细菌膜方案中。从环境转运的生物素被激活成生物素酰-5'-AMP,然后转移到BCCP受体蛋白,产生生物素酰-5'-BCCP。硫标记为橙色,AMP(和/或ATP/PPi)突出显示为红色。生物素受体蛋白BCCP用蓝色矩形表示。
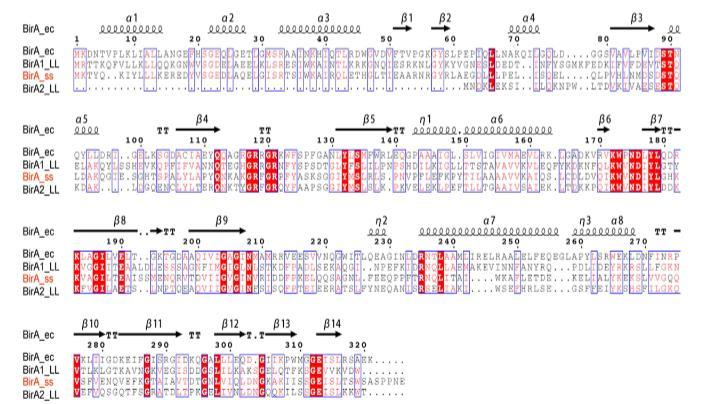
图2. 猪链球菌BirA直系同源物与原型大肠杆菌版本的序列比较。使用Clustal Omega程序(ClustalW2的更新版本)进行BirA蛋白的多序列比对,最终输出通过ESPript 3.0程序给出。相同残基为红底白字,相似残基为白底红字,变异残基为灰字,缺口用点表示。蛋白质二级结构以卡通形式显示(顶部),α:α-螺旋;β:β-折叠;T:转角;n:卷曲。

图3. 猪链球菌BirA蛋白的表征。(A)来自猪链球菌的重组BirA蛋白纯化的SDS-PAGE图谱。应用梯度SDS-PAGE(4-20%)分离蛋白质。(B)基于MS的猪链球菌BirA重组蛋白测定。与猪链球菌BirA天然形式匹配的肽片段用粗体和下划线字母(红色)给出。总共检测到54%的覆盖率。(C)猪链球菌BirA蛋白的建模带状结构。猪链球菌BirA蛋白包括三个结构域:N端DNA结合结构域(紫色),中央结构域(蓝色),和具有酶活性的C端结构域(黄色)。
猪链球菌BirA的生物素蛋白连接酶活性
我们采用体外和体内方法来解决猪链球菌BirA的BPL活性。用于功能互补的两个大肠杆菌birA突变体包括birAts温度敏感突变体(BM4062)和birA1 Km突变体(BM4092)。正如预期,带有/不带有空载体pBAD24的BM4062菌株在42°C的非允许温度下不能在M9琼脂平板上生长(图4A)。相反,质粒携带的birA_ss的阿拉伯糖诱导表达(甚至基础表达)支持birAts突变体BM4062在42°C下生长(图4A)。BM4062菌株在液体培养基中的生长曲线测量也再现了与琼脂平板获得的结果相似的结果(图4B)。pBAD24质粒携带的birA_ss的存在允许大肠杆菌birA1 Km突变体BM4092在补充低水平生物素(25 nM)的最小培养基上生长(图4C),这与生长曲线中看到的情况非常一致(图4D)。显然,它证实了猪链球菌BirA在替代模型大肠杆菌中具有BPL连接酶的作用。
为了进一步证明猪链球菌BirA的BPL功能,我们建立了体外酶反应分析。在这个BirA催化的反应系统中,使用的底物是AccB蛋白的生物素化结构域(指定为AccB87或BCCP87)(图5A,B),它在122位赖氨酸(K122)携带一个保守的生物素化位点(图5A,C)。应用薄层色谱法测定α-32P标记的ATP和生物素向生物素酰-AMP的转化(图5D)。原则上,它代表了第一个连接酶部分反应的直接证据(图5D),并且在添加受体蛋白AccB87后提供了第二个连接酶部分反应(即将生物素从生物素酰-5'-AMP转移到AccB87受体蛋白)的间接证明(图5D)。正如预期,猪链球菌BirA蛋白显示将生物素和[α-32P]-ATP转化为规范的生物素酰-5'-AMP中间体(图5D),并将生物素部分转移到AccB-87受体蛋白(图5D)。
随后,我们利用基质辅助激光解吸/电离来测量BirA连接酶催化的AccB-87生物素化水平,如我们最近所述。MS结果说明AccB87的计算质量为10324.2~10327.5(图6A),而生物素酰-AccB87的预期质量为10550.6(图6B)。总之,综合数据表明猪链球菌BirA作为BPL家族的功能成员起作用。
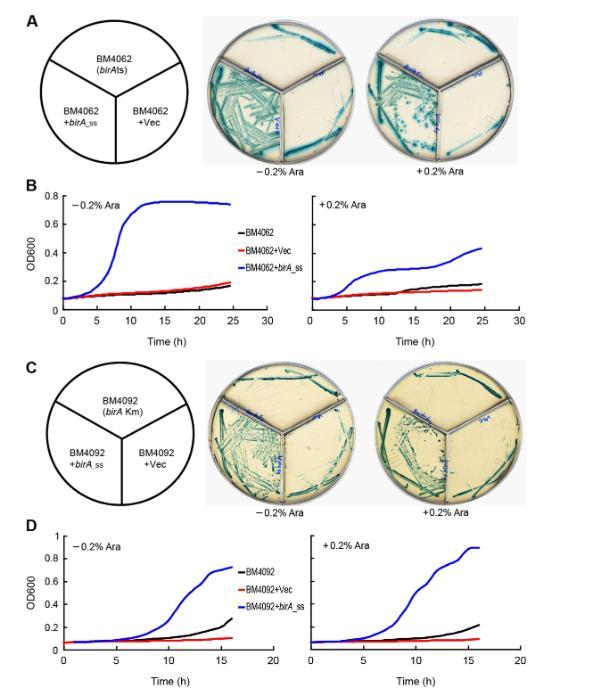
图4. 用推定的生物素蛋白连接酶编码基因birA对大肠杆菌birA突变体进行功能互补。(A)携带质粒携带的猪链球菌birA基因的大肠杆菌BM4062 birAts突变体在M9琼脂平板上的生长。(B)大肠杆菌BM4062 birAts突变体及其衍生物的生长曲线。大肠杆菌菌株在42°C(BM4062的非允许温度)下在确定的M9培养基(有/无0.2%阿拉伯糖)中维持约36小时。M9琼脂平板补充有0.5 mM X-gal加100nM生物素。(C)携带质粒携带的猪链球菌birA的大肠杆菌BM4092 birA1 Km突变体在M9琼脂平板上的生长。(D)大肠杆菌BM4092 birA1Km突变体及其衍生物的生长曲线。大肠杆菌菌株在30°C下在确定的M9培养基(有/无0.2%阿拉伯糖)中维持约36小时。M9琼脂平板补充有0.5 mM X-gal加25 nM生物素。细菌生长通过600 nm的光密度测量,使用BioScreen C微生物生长曲线分析仪自动记录。每个生长曲线分析进行三次,平均值用于此图。指定:Vec,载体(对照);ts:温度敏感;Ara,阿拉伯糖。
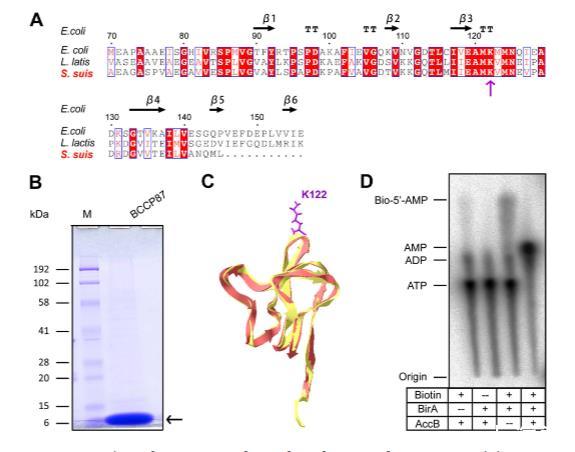
图5. 猪链球菌BirA生物素化AccB底物蛋白的证据。(A)BCCP受体蛋白(也称为AccB)的生物素化结构域的序列分析。(B)生物素底物结构域(BCCP87或AccB87)的SDS-PAGE图谱。(C)猪链球菌AccB蛋白生物素化结构域的结构建模。AccB的生物素化位点是122位的赖氨酸(K122)。(D)猪链球菌BirA的BPL酶活性TLC分析。缩写:M,蛋白质标记(Biorad);kDa,千道尔顿。加号(+)和减号(-)表示存在和不存在BirA蛋白、生物素或AccB87底物蛋白。
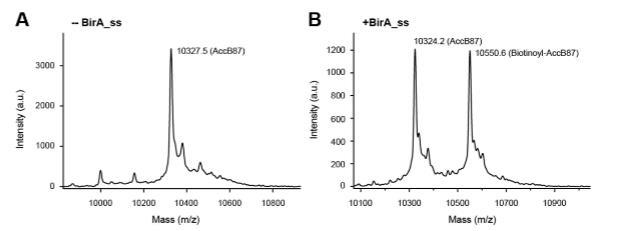
图6. 基于MS验证猪链球菌BirA催化的AccB87底物蛋白的生物素化。(A)未生物素化AccB87多肽分子量的MALDI-TOF测定。(B)通过猪链球菌BirA对AccB87底物进行生物素化的MALDI-TOF鉴定。AccB87的计算质量为10324.2~10327.5,猪链球菌BirA生物素酰-AccB87的预期质量(图B)为10550.6。指定:减号表示未添加BirA酶,加号表示添加BirA蛋白。
相关新闻推荐
2、不同环境条件下单细胞李斯特无害菌孔洞产生浊度的时间分布(二)
