2.3.模拟
使用方程(1)分析T_{text{det}}检测时间分布对四个(或多或少随机的)变量N_0、N_{text{det}}、mu和lambda(其分布取决于N_0)的依赖性。模拟研究在Excel中进行,并使用 Risk(Microsoft ExcelTM的风险分析加载项,4.05专业版,Palisade,美国,2000)进行分析,输入如下:
•每孔初始细胞数遵循泊松分布,平均每孔1个细胞;
•单细胞的延滞时间lambda(1)假设为Gamma分布,遵循Baranyi和Pin(2001)的理论。Gamma函数由两个参数alpha和beta定义。在最佳生长条件下(30°C,pH 7,0.5%NaCl),alpha取5,beta=0.5小时,导致单细胞预期延滞时间平均值为2.5小时(注意2.5小时是单细胞延滞时间的平均值,与群体延滞期不同),标准差为1.12小时。当每孔有多个细胞时,延滞时间使用Baranyi和Pin(2001)推导的公式估算。使用与方程(1)相同的符号,

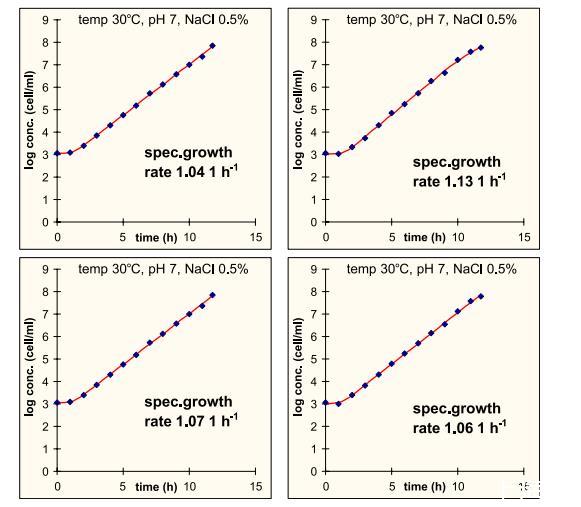
•比生长速率假设服从正态分布,平均值为1~h^{-1},标准差为0.03~h^{-1}。这对应于约3%的相对偏差,这是通过生成独立重复的活菌计数生长曲线确定的。图2显示了其中四条曲线,来自在最佳条件下培养的培养物。在不太有利的环境条件下也生成了类似的曲线。它们表明最大比生长速率是一个重现性很好的参数,在支持生长的环境中误差范围为1-5%。
•检测水平细胞数的分布假设为均匀分布,介于5times 10^{6}和1.5times 10^{7}个细胞/ml之间。
3.结果与讨论
3.1.模拟
使用蒙特卡罗抽样方法进行一万次迭代,得到T_{text{det}}检测时间的标准差为1.25小时,而个体延滞时间的标准差为1.12~h。在方差分析(ANOVA)术语中,1.12^{2}/1.25^{2}=80%的检测时间方差可由延滞时间的方差解释。注意,在此模拟中,延滞时间变异性相对较小。如果细胞受到胁迫,其延滞时间将更加分散,个体延滞时间变异性对总体变异性的贡献将变得更加主导。
模拟的T_{text{det}}检测时间保持了Gamma分布的形状。 Risk中所有可用的分布(对数正态分布等)都拟合到T_{text{det}}值。Gamma分布给出了良好的拟合,卡方值高达93%。T_{text{det}}的方差略高于个体延滞时间的方差。
结论是Gamma分布适合拟合T_{text{det}}值的分布,并且检测时间的大部分变异性可归因于延滞时间的变异性。
模拟还表明,为了获得检测时间分布的良好估计,所需的阳性孔数约为100。
3.2.实验结果
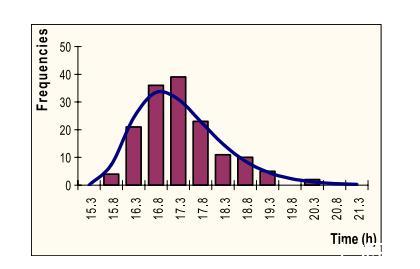
Gamma分布被证明适合拟合测量的T_{text{det}}检测时间(图3)。这与Wu等(2000)的发现不一致,他们使用正态分布拟合个体细胞延滞时间的分布。然而,他们报告每次稀释有40个重复,根据我们的经验,这不足以确定哪种分布最佳。
在Bioscreen微孔板的200个孔中,阳性孔的平均数量始终在125到175之间。基于泊松假设,这意味着在所有实验中N_{0}的平均值在1到2之间。
我们已经确定检测时间变异性的主要来源是个体延滞时间的变异性。为了测试生长条件的影响是否一致,在每种环境条件下进行了两到三次重复实验。在给定环境条件下,检测时间的总方差被分为三个独立的方差:
sigma^2_{text{total}}=V_R+V_E+V_H
其中(i)V_R源于Bioscreen读数不准确性;(ii)V_E源于环境条件影响的变异性;(iii)V_H源于细胞接种时生理状态的异质性。这是通过检测时间分布测量的(其主要来源是个体延滞时间的变异性)。
Bioscreen读数不准确性V_R通过高水平接种实验评估,并假设在任何环境条件下相同。环境条件引起的变异性V_E是在相同条件下进行的实验中检测时间均值的方差。均值以检测时间的标准差加权。最后,群体异质性引起的变异性V_H是通过从给定环境条件下集合的平均总方差中减去前述方差得到的。结果以R^{2}百分比表示,即由于接种时细胞生理状态异质性引起的总变异性比例(表1)。在大多数情况下,环境条件的重复是令人满意的(群体异质性引起的变异性高于95%)。然而,对于在pH 5.0或5.5下进行的实验,情况并非如此;在这些低pH值下,结果无法一致地重复。
表1
不同环境条件下检测时间的变异性来源
主要来源通常是细胞初始生理状态的异质性V_H,除了在低pH值时,环境因素影响的变异性V_E可能具有同等权重。
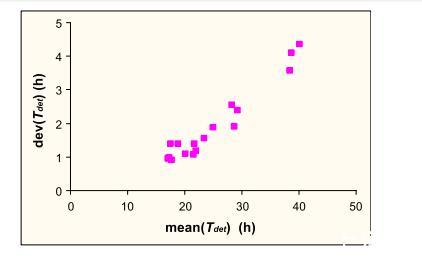
正如预期,生长条件抑制性越强,检测时间越长,其分布越分散。在图4中,对于每种生长条件,检测时间的标准差对其平均值作图。可以看出,在所研究的环境因素区域内,检测时间的标准差与其平均值之间的关系大致是线性的。然而值得注意的是,在NaCl浓度为4%时,标准差几乎与0.5%时保持相同水平,然后才增加。这与Patchett等(1992)的结果一致,他们发现钾和甜菜碱等渗透保护剂的增加(随着NaCl浓度增加而在细胞中积累)从约5%的NaCl浓度开始显著增加。
4.结论
控制病原菌延滞时间的变异性对于生产安全食品(例如最小加工食品)是可取的。然而,从技术上讲,获取足够且足够准确的单个细胞延滞时间数据是困难的。浊度检测时间可能提供解决此问题的方法。正如我们所表明的,如果初始细胞数较低,检测时间变异性的主要来源接近于个体延滞时间的变异性。作为初步近似,可以在检测时间与其标准差之间建立线性关系dev(T)~T。然而,如果生长缓慢,那么其他来源(“噪声”)可能匹配原始变异性的比例,并且线性关系可能不易被观察/重现。
致谢
这项工作部分在食品研究所项目CSG 434.1213A下准备,部分由欧盟项目QoL 2000-01145(BACANOVA)资助。
相关新闻推荐
1、基于全自动生长曲线分析仪研究单增李斯特菌低温生长机制(三)
2、系统性解析恶臭假单胞菌S16中尼古丁降解的分子机制(二)
