3.结果与讨论
3.1.CZ05菌株的分离与鉴定
通过使用活性污泥作为接种物,在添加了MT作为碳源和能源的1号培养基中,成功富集并分离了MT利用菌。首先选择低MT浓度是因为菌株必须适应利用MT并避免生长抑制。在生长培养基中采用低MT浓度后,接种高MT浓度的培养基。经过六次连续转移后,将培养物在琼脂平板上划线,并在含有气相MT的罐中培养约3天。当小菌落可见时,在显微镜下检查菌落。选择若干菌落进行传代培养。选择生长最快的菌落CZ05进行进一步研究。产孢的CZ05细胞呈杆状,大小为2.0-4.0x0.6-0.8微米,革兰氏阴性,兼性厌氧。在1号培养基平板上的菌落小而呈牡蛎白色,直径为1-1.5毫米。
Biolog微生物系统结果显示,CZ05菌株能充分利用95种碳源中的28种。该菌株被鉴定为多粘类芽孢杆菌,概率为100%。将16S rDNA序列在公共数据库中进行比对。结果显示该菌株为多粘类芽孢杆菌属,相似性为99%。因此,CZ05菌株被命名为多粘类芽孢杆菌CZ05。
3.2.发酵过程中多粘类芽孢杆菌CZ05的特性表征
利用MT的多粘类芽孢杆菌CZ05是兼性厌氧菌;因此,它可用于去除沼气中的MT。多粘类芽孢杆菌作为一种生物防治菌已被一些研究人员报道;然而,本研究是首次报道多粘类芽孢杆菌作为MT利用菌。因此,有必要研究多粘类芽孢杆菌CZ05在发酵过程中的特性。
如果向无机培养基中添加有机碳源,菌株会长得更快。因此,选择了四种介质来研究利用碳源的菌株。使用Bioscreen C通过每小时测量浊度来记录生长曲线(图2a)。多粘类芽孢杆菌CZ05既是化能自养菌(在1号培养基中),也是化能异养菌(在2号和3号培养基中)。多粘类芽孢杆菌CZ05在所有四种培养基中都能良好生长。然而,当培养基中存在有机碳源时,它生长迅速。延滞期和稳定期的生长顺序如下:延滞期为No.4>No.3≥No.2>No.1(与维持时间成反比),稳定期为No.1>No.4>No.3>No.2(根据维持时间)。CZ05菌株在4号培养基中具有短延滞期和长稳定期。
在两种介质(1号和4号)中进行分批培养,以进一步研究多粘类芽孢杆菌CZ05对MT的降解。结果如图2b所示。多粘类芽孢杆菌CZ05能有效降解1号和4号培养基中的MT;降解率在100小时分别达到91%和99%。4号培养基中的生物降解性能更好,菌体浓度更高(图2b)。这是生物滴滤池操作过程中的一个要求。因此,选择4号培养基进行进一步研究。
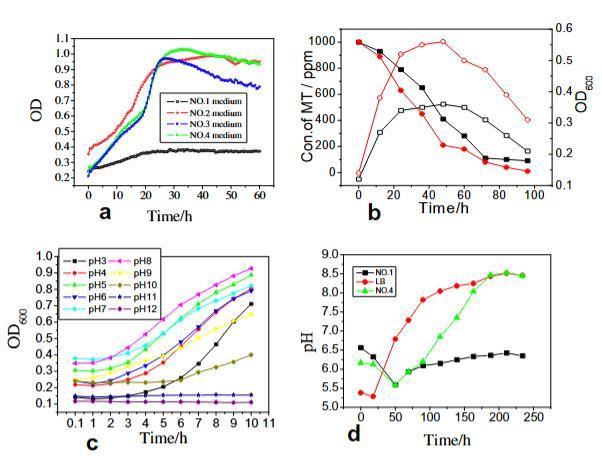
图2. 多粘类芽孢杆菌CZ05发酵过程特性。(a) 不同碳源的利用情况;(b) 降解MT的多粘类芽孢杆菌CZ05分批培养,符号:1号培养基(■)和4号培养基(●)中的MT浓度;1号培养基(□)和4号培养基(○)中的OD600值;(c) 在pH 3至12的4号培养基中的生长情况;(d) LB、1号和4号培养基培养过程中pH值的变化。
在4号培养基中,选择pH范围3-12作为培养条件,以研究多粘类芽孢杆菌CZ05的pH耐受性。结果通过Bioscreen C每小时测量浊度记录(图2c)。该菌株在pH 4-9范围内生长良好,但在pH 11-12时不生长。在pH 3和pH 10下观察到长达10小时的延滞期。
进行以下实验以确定CZ05菌株为何能在pH 3-12范围内生长。将多粘类芽孢杆菌CZ05接种到LB以及1号和4号培养基中,以测量培养基中pH的变化。如图2d所示,所有培养基中的pH值先下降后上升。在4号和LB培养基中,该值稳定在约pH 8.5,在1号培养基中稳定在6.5。CZ05菌株在其生长过程中产生碱性物质。当向培养基中添加有机物时,菌株能产生更多的碱性物质。这一特性可以提高酸性物质的溶解度,并解释了为什么多粘类芽孢杆菌CZ05在4号培养基中能在如此宽的pH范围内生长。
所有这些结果表明,多粘类芽孢杆菌CZ05适用于在生物滴滤池中去除沼气中的MT。
3.3.生物滴滤池中MT的降解
MT的去除率(R)和去除能力(Rc)通过R=(Cin-Cout)/Cin和Rc=(Cin-Cout)Q/V评估,其中Cin是入口浓度,Cout是出口浓度,Q是气体流速,V是塔的体积。
使用以火山石为载体材料的串联操作生物滴滤池(图1),通过接种多粘类芽孢杆菌CZ05培养物进行初始化。选择1号培养基作为串联操作生物滴滤池中的循环液,流速为6 L/h。在实验开始时,未向第一个生物反应器鼓入空气,并且未使用第二个填充塔。本实验的初始氮气流速为0.03 m3/h,EBRT为180秒,MT浓度约为10 ppm。启动期间第一个生物过滤器出口处的MT浓度为2 ppm。然后以0.01 m3/h的流量向第一个生物反应器鼓入空气(启用第二个填充塔)。第一个生物过滤器出口处的MT浓度约为0.1 ppm。3天后,入口MT浓度增加到20 ppm。尽管改变了空气流量和循环液流量,第一个生物过滤器出口处的MT浓度并未降至5 ppm以下(图3a)。在此阶段,循环液的pH约为6.0。当选择1号培养基作为循环液时,R约为70%,RC为40 mmol m-3 h-1。
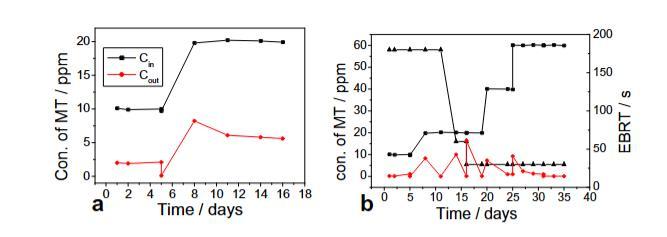
图3. 串联操作生物滴滤池中MT的去除情况:(a)使用1号培养基,(b)使用4号培养基。符号:氮气进口(■)和出口(●)中的MT浓度;空床停留时间(▲)
然后在串联操作生物滴滤池中选择4号培养基作为循环液。保留其他操作条件。当实验氮气流速设置为0.03 m3/h,EBRT为180秒,MT浓度约为10 ppm时,第一个塔出口处的MT浓度约为0.1 ppm,但在3天内增加到约1 ppm。以0.01 m3/h的流量向第一个生物反应器鼓入空气(同样启用第二个填充塔),第一个塔出口处的MT浓度设置为低于检测限(<0.05 ppm)。3天后,入口MT浓度增加到20 ppm,导致第一个塔出口MT浓度瞬时增加。MT浓度在接下来的3天内降至检测限以下。在第13天,流速增加到0.09 m3/h,EBRT减少到60秒。出口浓度增加到10 ppm,但在接下来的2天内降至0.1 ppm。在第16天,流速进一步增加到约0.18 m3/h,EBRT为30秒。第一个塔出口处的MT浓度增加到约5 ppm,但在接下来的3天内降至检测限以下。入口浓度逐渐增加(第20至25天为40 ppm;第25天起为60 ppm)(图3b)。这种逐渐增加导致出口MT浓度高;然而,浓度迅速降至1 ppm以下。在此阶段,第一个生物反应器中循环液的pH约为7.5,第二个生物反应器中为8.6。
相关新闻推荐
1、鸡大肠杆菌在不同限铁培养基中的生长曲线及对空肠弯曲菌的作用(二)
