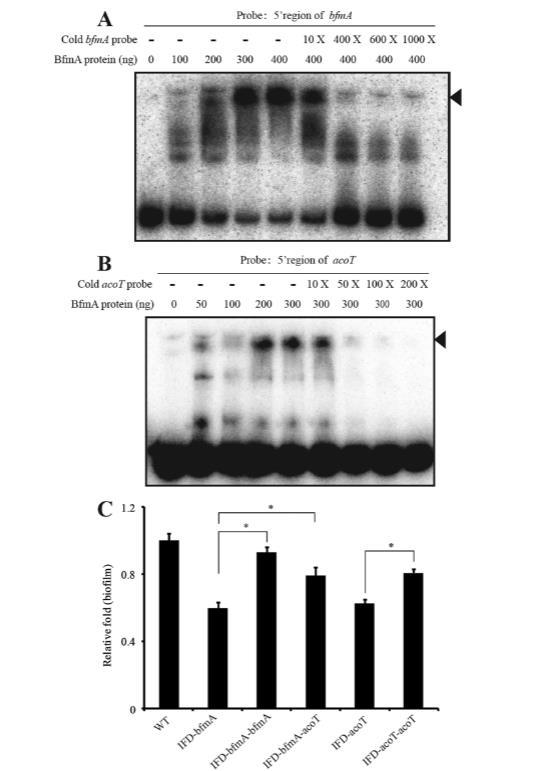
图6 BfmA直接结合bfmA和acoT启动子区域并调控生物膜形成。EMSA实验显示,BfmA可直接结合自身bfmA启动子区域(A)及acoT启动子区域(B)。实验中使用了4 fmol经[y-32P]ATP标记的bfmA和acoT启动子序列DNA。递增浓度的未标记探针(10倍至1000倍)作为BfmA蛋白结合的竞争剂。各图右侧黑色三角标示BfmA-DNA结合复合物。(C) bfmA对acoT具有上位效应,共同参与生物膜形成。检测不同菌株的生物膜量:IFD-acoT为acoT框内缺失突变株;IFD-acoT-acoT和IFD-bfmA-acoT分别为在Plac启动子控制下携带完整acoT基因的acoT和bfmA突变株。所有菌株(包括野生型)均携带相应空白或重组pBBRMCS2载体。柱状图表示标准差。*表示显著性差异(P<0.05,Student t检验;n=8)。
BfmA结合acoT的启动子区域以调控其表达和生物膜。为验证体内ChIP-PCR结果并确定BfmA是否是一个具有双链DNA结合活性的TF,通过PCR扩增bfmA-bfmK操纵子和acoT启动子区域的200 bp序列,用T4多核苷酸激酶通过[γ-32P]ATP进行末端标记,并用作体外EMSA的探针。如图6A和B所示,BfmA重组蛋白与标记的PbfmA和PSmlt0800 DNA探针形成了稳定的蛋白质-DNA复合物。BfmA与两个探针之间的结合事件是特异性的,因为加入浓度递增的未标记DNA探针会逐渐与32P标记的探针竞争,从而导致同位素信号减弱或完全消失。总之,体外和体内证据支持BfmA直接结合acoT和bfmA-bfmK操纵子的启动子区域并正向调控其转录的论断。
为了评估BfmA调控的acoT表达是否与生物膜相关,构建了acoT的框内缺失突变体(IFD-acoT)。如图6C所示,acoT的缺失导致细菌细胞聚集显著减少(38%)。虽然通过全长acoT基因进行遗传互补(菌株IFD-acoT-acoT)未能完全恢复该缺陷,但确实显著增加了突变体的生物膜量。此外,当在bfmA突变体中过表达acoT(菌株IFD-bfmA-acoT)时,由bfmA突变引起的生物膜缺陷得到显著抑制,尽管未能完全恢复。这些遗传学分析表明,acoT也参与生物膜发育,并且acoT转录水平降低是bfmA突变体中生物膜缺陷的原因之一。
讨论
组氨酸激酶是细菌用于检测环境刺激的主要细胞传感器;因此,它们被认为是开发新型抗生素化学物的候选分子靶点。基于对HK基因特征(62个基因)的生物信息学预测(图1),本研究成功构建了院内病原菌嗜麦芽寡养单胞菌的51个HK基因突变体,并鉴定出在以下方面存在表型缺陷的多个突变体:菌落形态、在半固体培养基上的细菌游动能力以及在聚苯乙烯表面的生物膜形成(图2和3)。在这些HK基因中,分子分析揭示了一个TCS,即BfmA-BfmK(Smlt4209-Smlt4208),可调控生物膜发育(图4D)。基于本研究收集的生物化学证据,BfmK是一个具有自激酶和磷酸转移酶活性的HK(图4C),而BfmA是一个能够在体外和体内结合双链DNA的转录因子(图5和6)。通过STRING数据库搜索预测BfmA-BfmK系统可能的功能伙伴后,随后的ChIP-PCR筛选鉴定出六个被BfmA结合的启动子。
实时定量PCR和EMSA显示,BfmA直接结合bfmA-bfmK操纵子和一个酰基-CoA硫酯酶编码基因(acoT,Smlt0800)的5'顺式调控序列,并正向调节它们的转录。结果表明BfmA-BfmK TCS具有自动调节功能,并控制acoT的mRNA水平,而acoT被证明参与生物膜形成(图6C)。据我们所知,这是首个系统研究嗜麦芽寡养单胞菌中TCS生物学功能的研究。它将促进我们未来旨在对抗这种细菌病原体引起的致命感染的研究。
嗜麦芽寡养单胞菌的基因组大小约为5.0 Mb,包含大量HK基因(62个),包括44个正统HK基因、16个混合HK、一个HWE家族HK和一个缺乏代表性H框的非典型HK。嗜麦芽寡养单胞菌的HK数量大于其具有相似基因组大小的近缘物种。例如,植物病原菌黄单胞菌属通常包含约38至60个HK基因。此外,如图1所示,嗜麦芽寡养单胞菌编码的信号传感域具有多样性,包括PAS、SBP、KdPD、2CSK、GAF和CHASE结构域。这表明嗜麦芽寡养单胞菌可能具有强大的能力来应对各种环境挑战。
通过对嗜麦芽寡养单胞菌HK基因的系统性失活及由此产生的表型改变,我们发现该菌的HK基因与其直系同源物存在显著差异。例如,HK RpfC及其同源RR RpfG是黄单胞菌属中调控生物膜形成、胞外多糖和酶生产、宿主毒力和过敏反应的主要TCS。有趣的是,对rpfC直系同源物Smlt2234进行插入失活,并未显著影响生物膜发育(图3A),这与黄单胞菌属的情况截然不同。蛋白质序列比对表明这两个HK是保守的(一致性65%)。然而,根据其基因组注释,Smlt2234(883个氨基酸)的信号输入区比含有五个预测跨膜螺旋的RpfC(726个氨基酸)更长,具有九个推定的跨膜螺旋。尚不清楚这种差异是由基因组注释引起还是代表了真实的蛋白质长度。至于另一个HK RavS,在引起十字花科植物黑腐病的野油菜黄单胞菌致病变种中,ravS的失活导致细菌游动性增加。
然而,正如我们之前的研究和图2C所示,ravS直系同源物Smlt2324的失活导致游动能力显著下降,突变体表现出与野生型细菌完全相反的表型变化。造成这种差异的原因尚不清楚。此外,在引起水稻白叶枯病的野油菜黄单胞菌致病变种和水稻黄单胞菌致病变种中,尽管vgrS(或colS)突变体生长非常缓慢,但该基因被证明是可突变的。然而,我们多次尝试失活vgrS直系同源物(Smlt3765)均告失败,表明vgrS可能是嗜麦芽寡养单胞菌中的必需基因,或者它对细菌生长的影响要大得多。总之,我们的研究结果表明,嗜麦芽寡养单胞菌和黄单胞菌属之间HK调控的功能差异使它们成为研究近缘生物信号级联进化的理想实验模型。
新鉴定的TCS BfmA-BfmK是嗜麦芽寡养单胞菌用于操纵生物膜的调控系统。BfmK是一个具有C端DHp和CA结构域的正统HK。其N端输入区功能未知,而其长度为89个氨基酸的周质传感器被两个推定的跨膜螺旋包围。HK的N端和C端之间存在一个HAMP连接子(图1)。因此,很难通过二级结构预测BfmK HK检测到的特定环境刺激。如图4C所示,BfmK使其自身的保守组氨酸残基发生自磷酸化,并且BfmK的磷酸化水平在BfmA存在下降低,表明BfmK可以将磷酸基团转移给BfmA,并且磷酸化BfmA的半衰期可能非常短(图4C);因此,它是一个经过生化验证的TCS。
BfmK和BfmA的直系同源物广泛分布于变形菌门中,但它们的功能此前尚未被研究。基于理论预测和随后的分子分析,我们鉴定出两个受BfmA通过启动子结合直接调控的下游操纵子(图5和6)。bfmA-bfmK的自动调节得到验证,表明存在bfmA-bfmK转录的正向调控反馈以放大该TCS的效率,正如在其他TCS中发现的那样。此外,BfmA可能通过正向调节acoT的转录来控制细胞内的CoA浓度,从而参与将酰基-CoA降解为游离脂肪酸和CoA,表明该TCS参与多种细胞代谢,尤其是脂肪酸的β-氧化。未来对BfmK-BfmA磷酸化过程、信号检测以及BfmA转录调控的研究将阐明该TCS在嗜麦芽寡养单胞菌生理和发病机制中的分子机制。
相关新闻推荐
1、微生物生长曲线分析仪助力嗜麦芽窄食单胞菌组氨酸激酶库的功能图谱绘制(二)
