如何通过OD值判断细菌生长处于哪个阶段?通过OD值(光密度)判断细菌生长阶段需结合生长曲线的动态变化及特征性规律。以下是具体判断方法、各阶段OD值特征及操作要点,帮助精准定位细菌生长状态。
核心判断方法:绘制OD值生长曲线
操作步骤
接种与培养:将细菌接种至新鲜培养基,37℃(或最适温度)振荡培养。
定时取样:每隔15分钟至2小时(根据生长速率调整)取样,每次取等量菌液。
测量OD值:使用分光光度计,在600nm波长(λ=600nm,避免色素干扰)下测定菌液OD600值,需提前用无菌培养基调零。
绘制曲线:以时间为横轴、OD值为纵轴,绘制生长曲线,对比典型阶段特征。
关键依据
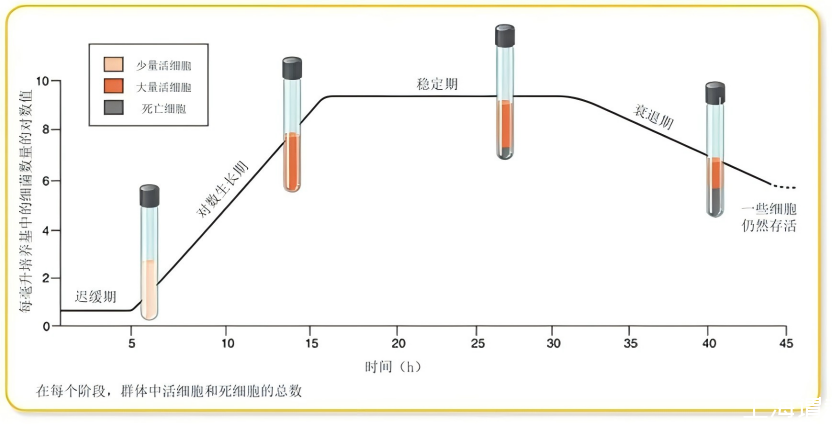
OD值生长曲线通常呈现“S”型,可通过曲线斜率、拐点及平台期判断阶段。
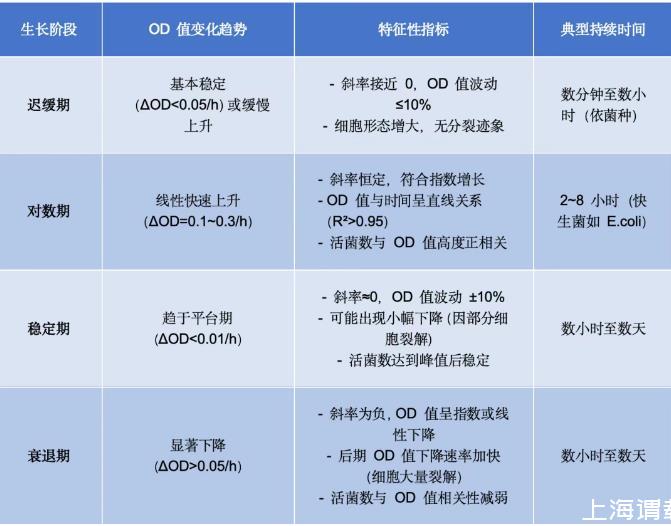
各生长阶段的OD值特征与判断标准
分阶段判断的关键细节
迟缓期的确认
特征:OD值在接种后0.5~2小时内无明显变化,或缓慢上升至0.1以下。
排除干扰:若OD值持续下降,可能是菌种老化或培养基不适(需对比空白组)。
对数期的判定
核心指标:OD值每30~60分钟翻倍(如从0.2升至0.4再升至0.8),且曲线呈严格直线(可通过线性回归验证)。
应用场景:实验中需取对数期细菌时,可在OD600=0.3~0.6时取样(此时细胞活性最高)。
稳定期的识别
转折点判断:当OD值从快速上升转为平稳(如连续2次测量OD值差值<0.02),且持续2小时以上,即进入稳定期。
辅助验证:可通过活菌计数(如平板菌落法)确认活菌数是否达到峰值并稳定。
衰退期的确认
关键信号:OD值连续3次测量呈下降趋势,且下降速率超过0.05/h(如从1.0降至0.8再降至0.6)。
形态学辅助:显微镜下可见大量裂解细胞、菌体碎片或芽孢(若菌种可产芽孢)。
特殊情况与干扰因素排除
OD值与活菌数的偏差
稳定期后期/衰退期:OD值可能因死菌未裂解而维持较高水平,但活菌数已下降(需结合平板计数验证)。
示例:若OD600=1.0但平板计数显示活菌数下降50%,提示进入衰退早期。
非生长因素干扰
培养基成分:若培养基含颗粒物(如蛋白胨杂质)或色素,需用未接种培养基作空白对照,扣除背景OD值。
细胞团聚:某些细菌(如链球菌)在稳定期易团聚,导致OD值波动,可通过涡旋振荡分散细胞后再测量。
低浓度菌液的判断
当OD600<0.1时,可能处于迟缓期或衰退末期,需延长培养时间观察趋势(如继续培养2小时,若OD值上升则为迟缓期,下降则为衰退期)。
实操流程总结
预实验确定线性范围:测定目标菌种的OD值-细胞浓度标准曲线,确认线性区间(通常OD600 0.1~0.8),超范围时需稀释菌液。
高频取样监测:在对数期前(OD600<0.5)每30分钟取样,避免错过转折点;稳定期后可每1~2小时取样。
多方法验证:OD值结合活菌计数(如CFU法)、显微镜观察(细胞形态)及代谢指标(如pH、底物消耗),提高判断准确性。
示例:E.coli生长曲线判读
接种后0~1小时:OD600从0.05升至0.1→迟缓期
1~4小时:OD600从0.1升至0.8(每小时增加0.175)→对数期
4~6小时:OD600维持在0.8~0.9→稳定期
6小时后:OD600降至0.6→衰退期
通过系统监测OD值动态变化并结合上述特征,可准确判断细菌生长阶段。需注意:不同菌种的生长速率及OD值峰值差异较大(如酵母菌OD600可达5.0,而某些厌氧菌仅0.5),需建立菌种特异性参考标准。
相关新闻推荐
3、禽呼肠病毒S1133毒株接种DF1细胞一步生长曲线的绘制——材料与方法
