Smlt4209-Smlt4208是一个控制生物膜形成的TCS。我们接下来专注于进一步研究Smlt4208,因为其突变体在生物膜形成方面稳定受损,而不影响生长。此外,该HK基因的其他直系同源物以前从未被研究过。如图4A所示,Smlt4208位于一个基因组位点,该位点包含一个RR基因(Smlt4209)、一个编码推定MarR家族转录因子的基因(Smlt4207)和几个功能未知的基因。我们使用不同算法进行的操纵子预测存在争议:ProOpDB预测Smlt4205-Smlt4209形成一个包含五个基因(从Smlt4205到Smlt4209)的操纵子,而DOOR数据库的理论预测和MicrobesOnline操纵子预测工具都提出了一个仅包含Smlt4208和Smlt4209的操纵子。为了通过实验解析该位点的潜在操纵子结构,设计了一系列引物,并使用RT-PCR检查这些基因之间的基因间转录。RT-PCR分析显示,Smlt4208和Smlt4209确实构成一个双顺反子操纵子,因为我们观察到两个基因之间PCR产物的扩增,这表明它们形成一个转录单元并构成一个完整的TCS(图4B)。然而,该分析未能检测到Smlt4209与Smlt4207之间或基因组中其他基因之间的转录联系。这一实验结果支持了DOOR数据库和MicrobesOnline操纵子预测工具所做的理论预测。因此,我们将该TCS命名为BfmK(组氨酸激酶,Smlt4208)和BfmA(应答调节因子,Smlt4209)。
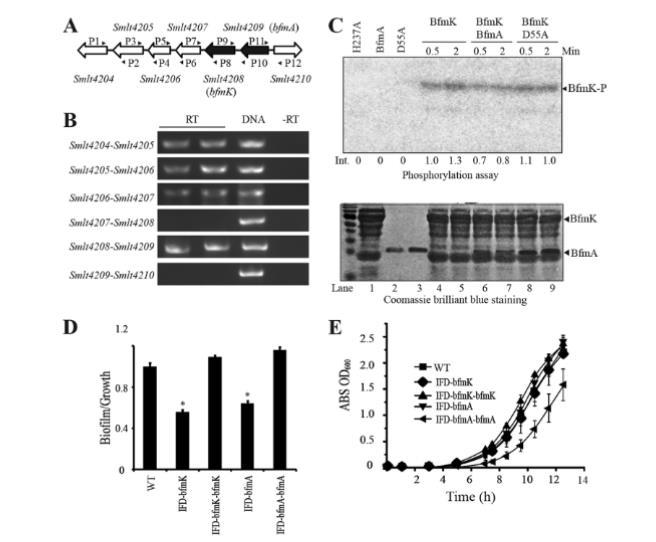
图4 Smlt4208-Smlt4209基因座的操纵子结构及其在生物膜形成中的作用。(A)Smlt4204-Smlt4209基因座的基因组定位。箭头表示基因及其转录方向。列出了基因名称,RT-PCR使用的引物(P1至P12)在箭头周围标明。(B)通过RT-PCR解析Smlt4204-Smlt4209基因座的操纵子结构。cDNA是使用随机引物,以在28°C NYG培养基中过夜培养的嗜麦芽窄食单胞菌ATCC 13637的总RNA为模板逆转录合成的。RT表示以RNA逆转录的cDNA为模板进行PCR扩增;DNA表示阳性对照,使用细菌总DNA作为PCR模板;-RT表示阴性对照,在cDNA合成过程中未加入逆转录酶。(C)BfmA-BfmK系统的体外磷酸化实验。使用了BfmK反转膜囊泡(50μg)和可溶性BfmA蛋白(20μM)。在指定时间向反应混合物中加入[y-32P]ATP。反应通过加入SDS上样缓冲液终止,样品通过12% SDS-PAGE进行分离。Int.表示通过Quantity One软件估算的条带强度。(D)bfmK(Smlt4208)和bfmA(Smlt4209)调控嗜麦芽窄食单胞菌ATCC 13637的生物膜形成。通过结晶紫染色法测量OD590值来量化细菌生物膜。柱状图表示标准差(n=8)。*表示P<0.01(通过Student t检验计算)。WT:野生型菌株;IFD-bfmK和IFD-bfmA:分别为bfmK和bfmA的框内缺失突变体;IFD-bfmK-bfmK和IFD-bfmA-bfmA:互补菌株。所有菌株,包括野生型菌株,都包含一个相应的空白或重组pBBRMCS2载体。(E)细菌菌株在丰富NYG培养基中的生长曲线。柱状图表示标准差(n=3)。
为了研究BfmK和BfmA的生化特性,使用pET30a和pET28a分别在大肠杆菌BL21(DE3)细胞作为宿主的情况下表达全长BfmA和BfmK蛋白。此外,还在对应于BfmA和BfmK蛋白磷酸化位点的遗传密码中引入了点突变,这些修饰的基因用于分别表达重组BfmA(D55A)和BfmK(H237A)蛋白。可溶性BfmA蛋白(纯度>98%)、BfmK的反向膜囊泡(BfmK比例>20%)及其重组突变体通过Ni-NTA亲和层析成功表达和纯化(图4C)。对重组蛋白进行的体外磷酸化分析显示,全长BfmK反向膜囊泡能够使其保守的His-237位点发生自磷酸化,而其重组形式BfmK(H237A)未能被磷酸化(图4C)。这一结果表明BfmK是一个具有自激酶活性的真正HK。当将BfmA加入反应混合物时,虽然未观察到代表磷酸化BfmA(BfmA-P)的条带,但BfmK-P的磷酸化水平降至对照的约80%。添加BfmA(D55A)蛋白并未降低BfmK-P的水平(图4C)。这一结果表明BfmK可以磷酸化其同源BfmA,但BfmA-P可能不稳定,半衰期太短而无法检测到。
由于bfmA和bfmK组织在一个操纵子中,bfmK(ΔSmlt4208)的插入失活可能对影响整个操纵子转录产生极性效应。为避免此缺陷,使用自杀载体pK18mobsacB通过同源双交换方法构建了bfmA和bfmK的框内缺失突变体(分别为IFD-bfmA和IFD-bfmK)。此外,将全长bfmA和bfmK序列进行PCR扩增并插入广宿主范围载体pBBRMCS2的多克隆位点,构建两个重组载体。然后将重组载体转化以遗传互补突变(菌株IFD-bfmA-bfmA和IFD-bfmK-bfmK)。在这两个构建体中,载体携带的bfmA和bfmK突变体受PlacZ启动子控制。然后测试了这些菌株的生物膜形成能力。
相关新闻推荐
2、乳酸乳球菌新型转录因子HdiR响应热与DNA损伤的分子机制研究(二)
3、人胚肺二倍体细胞不同代次Walvax-2细胞周期及衰老程度评定
