目的通过细胞生长曲线、流式细胞术检测人胚肺二倍体细胞不同代次情况,筛选评价人胚肺二倍体细胞衰老程度的生物学指标。方法将Walvax-2细胞分为16个代次,绘制生长曲线,观察不同代次Walvax-2细胞的生长增殖情况及细胞活力;通过核酸荧光染料碘化丙啶(PI)作为细胞活力分析的荧光探针使用流式细胞仪检测不同代次Walvax-2细胞周期时相和细胞凋亡情况。结果P20和P30的细胞活力明显强于P40和P50(均P<0.05),P40的细胞活力明显强于P50(P<0.05);G0/G1期所占百分比与细胞代龄间的增长无相关性(P>0.05),而S期、G2/M期和细胞碎片所占百分比与细胞代龄间的增长显著相关(均P<0.05)。结论通过绘制生长曲线可区分相隔较大代次的Walvax-2细胞的生长活力,在进行细胞衰老综合评定时,可通过PI作为荧光探针使用流式细胞仪检测细胞周期变化作为Walvax-2细胞的衰老程度综合评定的指标。
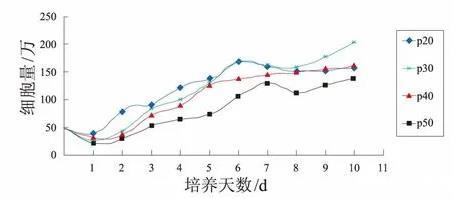
Walvax-2细胞20代、30代、40代和50代生长曲线
体外培养的人类细胞在分裂一定的次数之后就会停止增殖,称为细胞衰老。实际上在体外培养时不仅衰老的细胞逐渐增加,即使在年轻的细胞群体中也占有一定比例[2],随着分裂次数增多,细胞经过一系列的表型和基因表达改变,衰老细胞在整个细胞群体的生命周期中的百分比逐渐增大,直到所有的细胞均进入老化状态。其中,二倍体细胞与其他传代细胞相比,理论上不存在致肿瘤的潜在危险性[3-4]。其作为培养病毒疫苗时所需要的主要原材料,其质量的优劣,直接影响疫苗的质量和产量[5-6]。而细胞本身的特性也是疫苗生产环节中的重点。我国已上市的疫苗中,甲型肝炎疫苗、脊髓灰质炎疫苗、风疹减毒活疫苗、水痘减毒活疫苗分别使用了2BS、KMB-17、MRC-5细胞[7-9]。
研究发现,衰老细胞的细胞代谢能力降低,会出现脂类、蛋白质和DNA等细胞成分损伤。在细胞生长过程中稳定生长停止、衰老相关β-半乳糖苷酶的活性(senescence-associatedβ-galactosidase)、BMI-1基因、端粒酶RNA和p16(INK4A)的异质性诱导等标志物与细胞衰老密切相关[10-12]。目前,系统性评价细胞衰老程度的研究尚未取得进展[2,10-14]。本研究以通过检测不同代次人胚肺二倍体细胞生长曲线、细胞传代周期中细胞构成与细胞碎片变化情况等指标值,筛选评价人胚肺二倍体细胞衰老程度的生物学指标。
细胞生长曲线是测定细胞绝对生长数的常用方法,也是判定细胞活力的重要指标,是培养细胞生物学特性的基本参数之一[15]。但这种方法对同一样品要求计数后取平均值,不但操作繁琐和费时,而且误差较大,可达到20%~30%[16]。由于Walvax-2细胞具备自身稳定生长的特性,因而适合选用细胞生长曲线观察细胞的生长变化。本研究结果显示Walvax-2细胞增殖能力随代龄增加而下降,符合了细胞衰老程度与细胞增殖能力的关系,指标符合评价细胞衰老程度的需求。
流式细胞仪将流体喷射技术、激光光学技术、电子技术和计算机技术等集于一体,既可定性又可定量,具有简单、快速和敏感性高的特点,可进行多参数和活体细胞分析[17]。在细胞周期的分裂过程中可分为:M/G1、S、G2/M 3个时期。核酸荧光染料碘化丙啶[18]是一种常用的细胞核荧光染料,作为一种溴化乙锭的类似物,PI可选择性定量嵌入核酸双螺旋碱基对之间,在激光激发下,能够嵌入碱基对之间实现与双链DNA结合,虽然PI不能穿透细胞膜而被排斥在活细胞外,但是可以穿过破损的细胞膜而对细胞核染色[19],因此PI可作为细胞活力分析的荧光探针之一。本研究检测了Walvax-2细胞不同代次细胞周期3个时期中的细胞百分比,Walvax-2细胞的G2/M期、S期和细胞碎片均可以作为评价细胞衰老程度的指标。
综上所述,在体外培养人胚肺二倍体成纤维细胞时,可通过绘制生长曲线可区分相隔较大代次的Walvax-2细胞的生长活力,在进行细胞衰老综合评定时,可通过流式细胞仪检测细胞周期的变化,作为Walvax-2细胞的衰老程度综合评定的指标。
相关新闻推荐
1、一株具有高渗透压耐受性的嗜果糖植物乳杆菌的分离与特性研究(二)
3、新筛选PET塑料降解酶表征、降解能力、最佳条件、实际应用(一)
