表型鉴定。观察在NYG平板上培养24小时的细菌菌落形态。在丰富NYG培养基和有氧条件下的细菌生长通过自动化微生物生长曲线分析仪Bioscreen C(Oy Growth Curves Ab Ltd.,美国)测量。对于细菌游动性测定,将菌株用牙签接种到含有0.1%NYG的半固体琼脂中,在28°C培养12小时,并测量游动区直径。对于生物膜定量,使用先前报道的结晶紫染色方法。将嗜麦芽寡养单胞菌培养物定量接种到96孔聚苯乙烯板内的NYG培养基中,并将板在28°C静置培养5小时。同时,通过酶标仪(Tecan Infinite 200 Pro)在600 nm波长下的吸光度(OD600)测量96孔板中的细菌生长。在染色前用水洗涤板中的孔,然后用结晶紫(1%)染色20分钟,之后再洗涤。接着,将结晶紫染色剂溶解在无水乙醇中,并在酶标仪上于590 nm波长下测量生物膜量(n=8)。
RT-PCR和实时定量PCR分析。使用TRIzol(Invitrogen,美国)提取细菌总RNA,并使用NanoDrop分光光度计(Thermo Fisher,美国)进行定量。接着,使用DNA-free DNase(Life Technologies)纯化提取的RNA以去除任何污染的DNA。使用随机引物(Promega,美国)和Superscript III逆转录酶(RT)(Invitrogen,美国)从纯化的RNA合成cDNA。将嗜麦芽寡养单胞菌DNA模板作为PCR的阳性对照,转移信使RNA(tmRNA)扩增作为RT-PCR的上样对照;在cDNA合成过程中缺少逆转录酶的样品作为阴性对照,以评估潜在的DNA污染。用于扩增样品基因的引物列于表2。
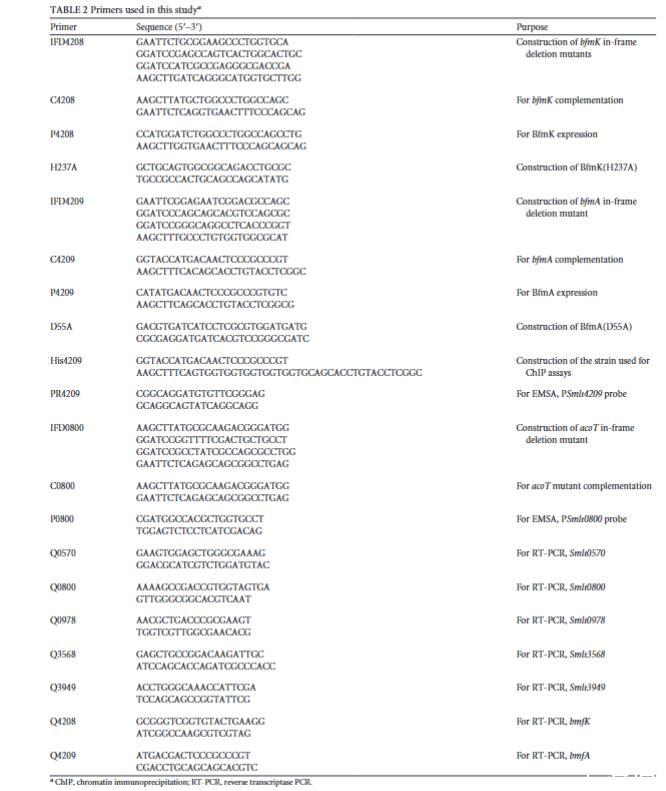
蛋白质表达、纯化和磷酸化分析。分别使用pET28a和pET30a(Novagen)表达载体在大肠杆菌BL21(DE3)细胞中表达重组BfmA-His6和BfmK-His6蛋白。用于构建重组载体的PCR引物列于表2。根据制造商手册(Novagen),通过Ni-次氮基三乙酸(NTA)亲和层析纯化BfmA-His6。根据我们先前研究中使用的方法制备BfmK HK的反向膜囊泡。纯化的蛋白质和反向膜囊泡储存在储存缓冲液(50 mM Tris-HCl,0.5 mM EDTA,50 mM NaCl,5%甘油;pH 8.0)中。
我们根据先前使用的方法进行体外磷酸化分析。简而言之,对于自磷酸化分析,将BfmK反向膜囊泡在20微升体积的自磷酸化缓冲液(50 mM Tris-HCl[pH 7.8],2 mM二硫苏糖醇[DTT],25 mM NaCl,25 mM KCl,5 mM MgCl₂)中与含有10微居里[γ-³²P]ATP(PerkinElmer)的100微摩尔ATP在28°C孵育10分钟。为了检测BfmK和BfmA之间的磷酸转移,将20微摩尔纯化的可溶性BfmA加入反应混合物中,然后在28°C孵育图4所示的时间。通过加入6×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液终止反应。然后将磷酸化蛋白质在12%SDS-PAGE凝胶上进行分离。电泳后,将凝胶暴露于磷屏1小时,并通过PhosphorImager系统(Amersham Biosciences)记录凝胶的放射性信号。
ChIP(染色质免疫沉淀)。用于染色质免疫沉淀(ChIP)的方案遵循先前的一项研究。简而言之,将嗜麦芽寡养单胞菌在NYG培养基中培养至OD600为0.4。用1%甲醛对细胞进行交联,随后用0.5 M甘氨酸淬灭5分钟。通过离心收集的细菌培养物(4毫升)在10毫升冷的TBS缓冲液(20 mM Tris-HCl[pH 7.5],150 mM NaCl)中洗涤两次,然后重悬于1毫升裂解缓冲液(10 mM Tris[pH 8.0],20%蔗糖,50 mM NaCl,10 mM EDTA,10毫克/毫升溶菌酶)中。将IP缓冲液(50 mM HEPES-KOH[pH 7.5],150 mM NaCl,1 mM EDTA,1%Triton X-100,0.1%脱氧胆酸钠,0.1%SDS,1 mM苯甲基磺酰氟)加入细菌细胞悬浮液中,并使用Diagenode Bioruptor UCD-300超声仪(Diagenode,美国)对细胞进行超声处理,以产生平均约200 bp的DNA片段。离心后,用20微升蛋白A在4°C慢速旋转器上预清除溶液10分钟,并保留100微升等分试样作为上样对照DNA(输入样本)。对于ChIP分析,将20微升蛋白A-琼脂糖珠(50%浆液)和2微升抗His6抗体加入800微升等分试样中,并在4°C慢速旋转下孵育过夜。第二天,通过离心收集珠子,并用IP缓冲液和洗涤缓冲液(10 mM Tris-HCl[pH 8.0],250 mM LiCl,1 mM EDTA,0.5%Nonidet P-40[相当于Triton X-114],0.5%脱氧胆酸钠)洗涤。通过加入100微升洗脱缓冲液(50 mM Tris[pH 7.5],10 mM EDTA,1%SDS)从珠子上洗脱免疫沉淀的染色质,并将溶液在65°C孵育10分钟。加入RNase A以去除RNA污染。使用蛋白酶K进行交联逆转。使用PCR纯化试剂盒(Qiagen,美国)纯化DNA。对于半定量PCR,使用1微升洗脱的DNA和1微升对照DNA作为模板,用适当的引物进行PCR。捕获的DNA量相对于对照输入DNA进行标准化。
EMSA(电泳迁移率变动分析)。对于电泳迁移率变动分析(EMSA),使用表2所示的引物通过PCR扩增bfmA和acoT操纵子的启动子区域。使用T4多核苷酸激酶(New England Biolabs[NEB],美国)用[γ-³²P]ATP对PCR产物进行末端标记。将BfmA蛋白(1微克)和探针(4 fmol)在反应缓冲液[10 mM Tris(pH 7.0),50 mM KCl,1 mM DTT(pH 7.5),2.5%甘油,5微升MgCl₂,50纳克/微升poly(dI-dC),0.05%NP-40,和10 mM EDTA]中孵育20分钟。加入DNA上样缓冲液(0.25%溴酚蓝,40%蔗糖)终止反应,样品通过8%非变性PAGE进行分离。使用磷屏检测放射性信号。使用不同浓度的未标记DNA探针作为竞争者。
相关新闻推荐
1、线虫模型:泛藻凝集菌临床与植物有益菌株表型比较研究(二)
2、油酸包封的银纳米粒子对PMMA基骨粘固剂机械性能和细胞毒性的潜在影响
