阴性对照处理包括J2爪哇根结线虫仅与GMM一起孵育。包括一个阳性对照处理,由化学杀线虫剂Vydate P(100 mg/l)组成。用Parafilm密封管子,并在25°C黑暗条件下孵育24小时。通过40倍放大镜观察测定存活J2线虫的浓度作为毒性指标。根据不动性和存在僵直身体来判断死亡个体。处理包括三个重复管,采用完全随机设计。进行了两个独立试验。
在按如下方法制备的线虫生长培养基上维持秀丽隐杆线虫SS104:将3克NaCl、17克琼脂和2.5克蛋白胨加入975毫升蒸馏水中。将溶液高压灭菌,然后冷却至55°C。加入1毫升1M CaCl2、1毫升5毫克/毫升胆固醇(溶于乙醇制备)、1毫升1M MgSO4和25毫升1M KPO缓冲液(108.3克KH2PO4,25.6克K2HPO4,加水至1升,pH 6.0)。使用大肠杆菌OP50作为食物来源。菌株SS104是一种温度敏感型突变体,在25°C孵育时无法繁殖,这确保了测定期间线虫数量恒定。在实验前,通过漂白程序同步线虫的年龄分布。简而言之,用5毫升无菌M9缓冲液洗涤含有卵的琼脂平板表面,以1500 xg离心2分钟,将沉淀重悬于4.5毫升漂白溶液(0.5毫升水,2.5毫升1M氢氧化钠,和4毫升约4%次氯酸钠)中。将管子间歇性轻轻混合约5分钟,以杀死除卵以外的所有线虫形态。通过以1500 xg离心1分钟停止反应。用M9缓冲液洗涤沉淀三次,重悬,然后在25°C下轻轻搅动孵育14小时。将同步化的线虫(L1幼虫阶段)置于铺有大肠杆菌OP50的NGM琼脂平板上,在25°C孵育2天以获得L4成虫阶段线虫,按上述方法从琼脂平板中回收。
将泛菌属菌株、大肠杆菌OP50和用作此试验阳性对照的肠道沙门氏菌CECT 4595的细菌细胞悬浮液铺在NGM上,并在适当温度下生长24小时。对于存活测定,将收集的蠕虫转移到细菌(处理)的新鲜菌苔平板上(每平板150条)。每个测定进行三次重复。对于使用细菌菌株无细胞培养上清液的测定,将培养物在LB肉汤中于28°C生长48小时,肠道沙门氏菌CECT 4594除外,其在37°C孵育。
将培养物以10,000 xg离心10分钟,上清液通过0.22μm孔径的滤膜过滤除菌。将400μl滤液分装到24孔板中,每孔含有50μl大肠杆菌OP50在M9缓冲液中的悬浮液和50μl同步化的L4线虫(约100条个体)。通过40倍放大镜观察,在7天(细菌细胞悬浮液)或5天(无细胞培养上清液)内对蠕虫死亡率进行评分。根据不动性和存在僵直身体来判断死亡个体。该测定进行三次重复。使用750μM叠氮化钠作为阳性对照。
溶血活性。 在固体和液体培养基中评估溶血活性。使用化脓性链球菌ATCC 19615和蜂毒肽作为阳性对照。在固体培养基中,通过在含有5%(v/v)绵羊或马红细胞的血琼脂基础培养基上以适当稀释度一式三份铺板细菌菌落,在28°C孵育48小时后,通过菌落周围是否存在透明晕圈来评定溶血活性。在液体培养基中,使用悬浮于林格氏液中的细胞和从LB肉汤中培养48小时后获得的无细胞培养上清液。通过测定从绵羊或马血(5% v/v)的红细胞悬浮液中释放的血红蛋白来评估溶血作用。
将血液以6000 xg离心5分钟,用Tris缓冲液(10 mM Tris, 150 mM NaCl, pH 7.2)洗涤三次,并稀释十倍。将等分红细胞(65μl)与65μl细菌细胞悬浮液(5 x 10^8 CFU/ml)或无细胞培养上清液在三份中于96孔反应板中混合,并在37°C连续振荡孵育1小时。孵育后,将管子以3500 xg离心10分钟。将等分上清液(80μl)转移至100孔微孔板中,并用80μl去离子水稀释。使用Bioscreen C生长曲线分析仪在540 nm波长下测量吸光度作为溶血指标。在添加了蜂毒肽(100μM)作为阳性对照的Tris缓冲液中测定完全溶血。
遗传毒性。 在艾姆斯试验之前,对培养上清液进行测定以确保其对沙门氏菌菌株无细胞毒性(存活率高于50%)。按照OECD测试指南471中的描述进行细菌回复突变试验(艾姆斯试验),使用两种沙门氏菌鼠伤寒血清型参考菌株(TA98,用于检测移码突变;TA100,用于检测碱基对置换),无需代谢活化。按上述溶血活性测试方法制备泛菌属无细胞培养上清液。制备两种沙门氏菌菌株的过夜LB肉汤培养物。通过将0.1 ml泛菌属无细胞上清液与3 ml顶层琼脂、0.2 ml组氨酸-生物素溶液(0.5 mM)和0.2 ml浓度为5 x 10^8 CFU/ml的沙门氏菌悬浮液混合,并在基本培养基上铺板来进行遗传毒性测定。使用1.25和2.5μM叠氮化钠作为TA100菌株的诱变剂,使用2.5和5.0μM 2-硝基芴作为TA98菌株的诱变剂。测定进行三次重复。当诱导回复突变体数与自然回复突变体数之比≥2时,判定遗传毒性为阳性。
统计分析。 使用单因素方差分析确定处理效应的显著性。使用P < 0.05水平的Waller-Duncan检验进行均值分离。使用PC-SAS的GLM程序进行分析。
结果与讨论
最近的基因型和生化分析对泛藻凝集菌生物防治菌株和临床菌株的区分有限,而本文我们使用表型比较获得了更大程度的区分。因此,可以基于对植物病原菌的拮抗活性清楚地区分植物有益菌株和临床菌株。我们没有发现任何生物防治菌株有毒性的证据,但使用线虫模型发现两种临床菌株有致病性的证据。这些发现支持了先前报道的临床和生物防治菌株中缺乏遗传毒力决定因子。
所有七种植物有益菌株在针对常见植物病原菌扩展青霉和解淀粉欧文氏菌的测定中,均显著抑制了至少一种植物病害,其中三种菌株在两种测定中均显示出显著的生物防治活性。只有两种植物有益菌株(Eh318和Eh1087),它们最初是作为火疫病生物防治剂被筛选出来的,未能抑制真菌病原菌扩展青霉(图1)。
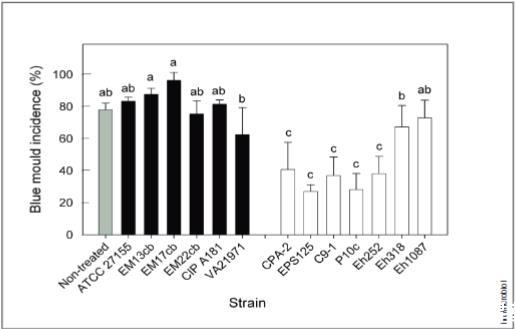
图1. 泛菌属临床菌株(黑柱)和植物益生菌株(白柱)对'金冠'苹果由扩展青霉引起的青霉病的生物防治效果。数值为三次重复的平均值,每次重复包含三个果实,每个果实有三个创口。误差线表示平均值的95%置信区间。根据Waller-Duncan检验,标有相同字母的青霉病腐烂率柱状图无显著差异(P<0.05)。
类似地,只有两种最初是作为采后腐烂病生物防治剂筛选出来的菌株(CPA-2和EPS125)未能抑制花朵中的细菌病原菌解淀粉欧文氏菌(图2),而所有火疫病生物防治剂都是有效的。观察到的生物防治菌株的抑制活性并不令人惊讶,因为它们先前是在针对特定目标病原菌的大量环境分离株筛选中基于其优异的生物防治活性而被筛选出来的。相比之下,六种临床泛菌属菌株在采后测定或花朵测定中通常无效或仅有微弱效果。六种临床菌株中有四种抑制了解淀粉欧行氏菌在花朵中的感染,尽管通常程度低于生物防治菌株(图2)。
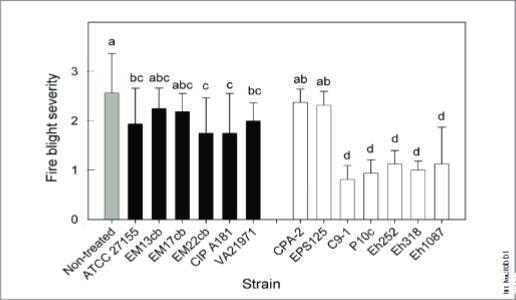
图2. 成团泛菌临床菌株(黑色柱)与植物益生菌株(白色柱)对梨火疫病的生物防治效果。数据为八个花朵三次重复的平均值。误差线表示均值的95%置信区间。根据Waller-Duncan检验,标有相同字母的火疫病严重程度柱状图差异不显著(P<0.05)。
