这些数据表明,在我们的实验条件下,肠道微生物群似乎不参与上鞭毛体寄生虫数量的急剧减少。我们研究了使用锥鞭毛体寄生虫(一种被认为更坚固且更能抵抗脊椎动物宿主血液环境的形态,并且对应于自然条件下感染昆虫媒介的阶段)是否可以观察到这种减少。使用在培养物中上鞭毛体和锥鞭毛体均组成型表达荧光素酶(pTREX-Luc整合构建体)的Dm28c品系,我们观察到在两种寄生虫生活史阶段,24小时后发光信号均大幅下降。
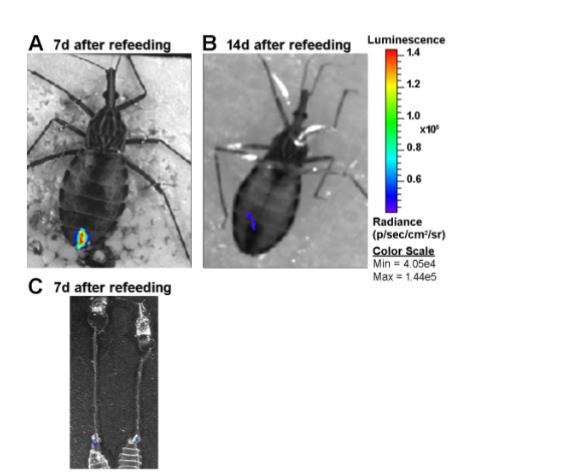
图4. 感染昆虫摄食后的生物发光成像。体内(A、B)与离体(C)成像显示,在再次饲喂后一至两周内,大部分寄生虫仍密集聚集于直肠部位,表现为消化道末端呈现点状发光信号。
虽然锥鞭毛体寄生虫表达的发光强度比上鞭毛体形式低约10倍(这与感染性形式中RNA pol I转录速率降低10倍相符),但从6小时到24小时,它们表现出的发光信号减少幅度高于上鞭毛体中观察到的,分别占摄入寄生虫的0.77%和16.2%。观察到昆虫和血液锥鞭毛体形式均表现出相似的大幅光子发射下降,表明冷休克不是上鞭毛体寄生虫裂解的原因。我们接下来研究了锥鞭毛体减少是否也不受肠道微生物群的影响,使用一龄若虫,其优势是天然无肠道微生物群。无菌一龄若虫喂食补体灭活血液,其中含有克氏锥虫锥鞭毛体或上鞭毛体(约10^6个细胞/若虫),在存在或不存在罗氏红球菌(10^3个细菌/若虫)的情况下表达荧光素酶。在感染或未感染罗氏红球菌的两种寄生虫生活史阶段的若虫中,在血液餐后24小时观察到发光信号下降幅度相似,这表明在血液餐后最初24小时内,肠道微生物群不参与两个阶段的寄生虫裂解。
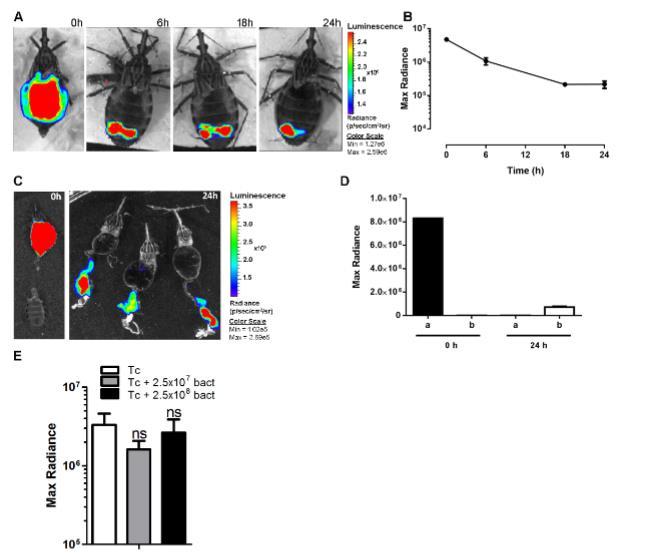
图5. 克氏锥虫在感染后前24小时内于昆虫消化道中表达荧光素酶的生物发光成像时序发展。(A)图像显示中肠(AM)内发光信号的急剧减少。(B)对A图所示不同时间点获取的整段肠道发出BLI信号的量化分析。(C)离体BLI证实感染后24小时信号仅存在于后肠(PM)。(D)感染后0小时和24小时中肠(a)与后肠(b)发出BLI信号的量化。(E)微生物群对寄生虫裂解及BLI信号减弱的影响。实验组分别单独感染寄生虫(Tc)、或感染寄生虫同时添加每毫升血液含2.5x107或2.5x108株红球菌。进行两次独立实验(n=16),结果采用单因素方差分析。
由于BLI方法固有的高检测限,我们使用GFP标记的寄生虫来检查相对寄生虫丰度和分布、其形态以及宿主组织关联。在感染后24小时,AM显示的相对寄生虫密度低于预期,并且主要由靠近上皮的寄生虫代表。这种现象是由于存在大量完整的红细胞,这些红细胞使寄生虫分散,以及AM的球状形态,阻止了位于更深部位的GFP标记寄生虫的可视化。S1视频说明了这一特征,显示在上皮边缘具有高荧光发射信号的寄生虫以及中肠管腔深处具有低发射信号的寄生虫。从感染后第4天到第7天,当AM中的总寄生虫种群减少时,我们观察到自由游动的寄生虫和形成玫瑰花结的锥虫聚集体,其中一些聚集体与肠壁相关。在PM中,虽然在此期间总寄生虫数量保持不变,但我们检测到大量寄生虫集中在PM的某些区域,通常是锥虫聚集体。S2视频显示,在PM中计数的寄生虫中,有些是自由游动的,而另一些似乎通过微绒毛周围膜附着在上皮上。在H中,我们观察到从感染后第4天到第21天寄生虫数量相对增加,其中很大一部分通过鞭毛附着在直肠壁上,正如Schaub等人先前报道的那样。

图6. 在存在或缺失R.rhodnii条件下,罗蛉消化管内表鞭毛体与锥鞭毛体表达荧光素酶的时间进程对比(感染后24小时内)。(A) 6小时与24小时表鞭毛体和锥鞭毛体发光强度代表性数值。表鞭毛体6小时vs24小时:P<0.01;锥鞭毛体6小时vs24小时:P<0.0001(经ANOVA方差分析及Tukey多重比较检验)。(B) 成虫感染不同数量表鞭毛体(Epi)或锥鞭毛体(Trypo)后的生物发光成像信号量化。(C) 无菌一龄若虫摄食表鞭毛体(Epi)或锥鞭毛体(Trypo)形态(浓度10^7细胞/毫升)后,在存在或缺失R. rhodnii条件下的生物发光成像信号量化。各发育阶段±细菌处理组中,6小时vs24小时比较均P<0.001(经ANOVA方差分析及Tukey多重比较检验)。
自然条件下克氏锥虫肠道定植动力学的评估
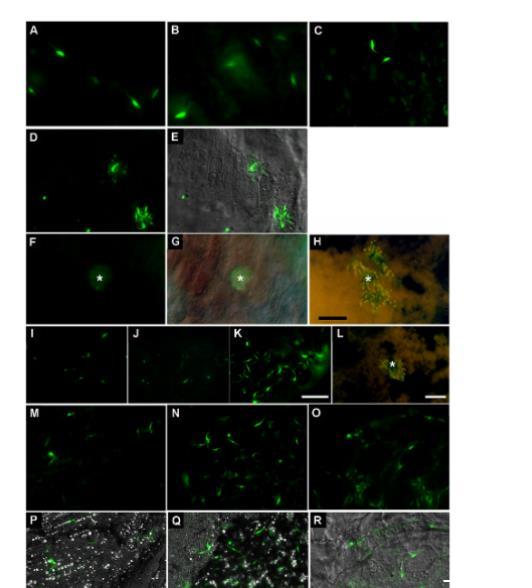
图7. 感染GFP标记寄生虫昆虫消化道荧光显微镜图像。图像显示绿色荧光寄生虫定殖于前肠(AM)(A-H)、中肠(PM)(I-L)和后肠(H)(M-R)。(A-C) 分别为感染后第1、2、7天AM荧光图像,显示自由游动寄生虫。(D-H) 荧光与DIC图像显示感染后第1天(D,E)和第4天(F-H)的寄生虫聚集体。星号指示与肠壁相关的寄生虫聚集体。(I-K) 分别为感染后第1、2、7天PM荧光图像。(L) 感染后第4天荧光图像,星号指示PM管腔内的寄生虫簇。(M-R) 分别为感染后第4(M,P)、7(N,Q)和21(O,R)天H的荧光与DIC图像。比例尺:(A-H) 50μm;(I-K) 50μm;(L) 10μm;(M-R) 50μm。A-E、I-K、M-Q及F-H、L图像分别使用蔡司Axioplan 2荧光显微镜和蔡司Axioplan 2荧光显微镜拍摄。
导致高检测灵敏度(CL Brener和Dm28c品系的检测限分别为1和0.01寄生虫当量)的qPCR高度优化构成了评估昆虫自然感染动力学的原理证明,这些昆虫经常被低密度的血液锥鞭毛体(≤10^4寄生虫/昆虫)感染。因此,我们评估了人工喂食含有10^5锥鞭毛体/毫升或10^5上鞭毛体/毫升(Dm28c)补体灭活感染血液的昆虫成虫的寄生虫载量,这些昆虫在三周内的不同时间段后被解剖。在用上鞭毛体或锥鞭毛体喂养的昆虫肠道不同区段中观察到相似的寄生虫载量分布图。昆虫最初感染了大约2.5x10^4个寄生虫,与之前观察到的类似,在感染后最初24小时内,约90%的这些寄生虫被裂解(锥鞭毛体和上鞭毛体分别为87.32%和87.35%),优先定植于AM(分别占存活上鞭毛体和锥鞭毛体的97.18%和98.9%)。
最初存在于PM中的上鞭毛体常驻种群在24小时内繁殖了12.9倍以定植PM,而在用锥鞭毛体喂养昆虫的情况下,我们观察到较低的3.1倍增加,这是由于静止的锥鞭毛体分化为分裂的上鞭毛体。在H中,锥鞭毛体寄生虫种群在感染后第7天达到顶峰(约10^4寄生虫当量),并在两周内稳定下来,与PM中一样,上鞭毛体和锥鞭毛体分别约为10^3至10^4寄生虫当量。感染后三周,AM种群几乎消失(约1个寄生虫当量)。与先前观察到的类似,在用上鞭毛体或锥鞭毛体感染的昆虫重新进食两周后,每个肠道区段内维持了恒定水平的寄生虫,尽管用锥鞭毛体感染的昆虫略高。因此,锥鞭毛体对昆虫的感染率几乎与上鞭毛体相同,显示出低水平锥鞭毛体对肠道定植的相似动力学,导致重新进食两周后完全有能力的媒介。我们还可以得出结论,肠道中波动的种群峰值幅度是昆虫在感染开始时摄入的寄生虫数量的函数。
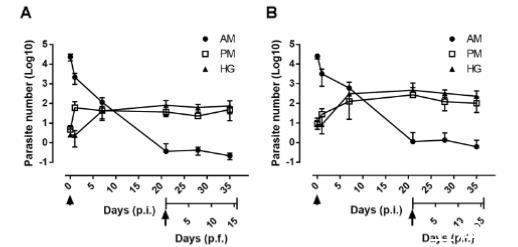
图8. 自然条件下实时监测克氏锥虫在长红锥蝽肠道内的定植过程。追踪感染后(p.i.)和吸血后(p.f.)前中肠(AM)、后中肠(PM)及后肠(H)中上鞭毛体(A)和循环后期锥鞭毛体(B)的寄生虫发育情况。成虫饲喂浓度为10⁷细胞/毫升。箭头符号与箭头分别表示初始感染锥鞭毛体时间及再次吸血时间(感染后21天)。在不同时间点解剖昆虫,分别从各肠段提取总DNA,通过qPCR技术评估寄生虫数量。每个时间点代表一次实验(n=8)。
讨论
在本研究中,我们报告了一种高灵敏度和精确的qPCR策略,结合定性和半定量成像分析,用于量化消化道每个区段的寄生虫载量,并提供了对昆虫肠道定植动力学的见解。虽然血液消化构成了昆虫肠道的主要功能,但人们对血液餐后媒介反应中涉及的蛋白质以及它们如何影响锥虫感染和肠道定植知之甚少。在其穿越昆虫肠道的旅程中,寄生虫必须适应它将遇到的几个恶劣环境,首先是储存血液和裂解红细胞的AM,然后是消化血液蛋白和解毒血红素以产生大量结晶血红蛋白的PM,最后是尿酸盐晶体积累和血液残留物排泄的直肠。所有这些来自血液消化的副产物在DNA纯化过程中容易共沉淀并抑制进一步的PCR反应。在这方面,使用CTAB提取DNA比其他纯化方法(例如酚-氯仿、硅-DNA结合技术)具有几个优势:(i)它去除了多糖,例如几丁质(后肠原角质层的组成部分)和假定的长红猎蝽消化道中高度丰富的细菌多糖(例如,红球菌属产生的荚膜多糖);(ii)CTAB酸性缓冲液(pH 4.6)导致血红素和血色素沉淀的形成,因此不会干扰DNA回收和PCR反应效率。
关于本研究中开发的qPCR策略,Moser及其同事设计并由Cummings和Tarleton修改的引物被发现可有效准确地量化组织中的寄生虫载量,与使用的寄生虫品系(例如Dm28c(TcI)和CL Brener(TcVI))和寄生虫阶段无关。此外,使用外源DNA质粒而不是内部标记(昆虫DNA标记)掺入昆虫肠道样品中,对于确保适当的归一化以准确量化寄生虫载量至关重要,因为肠道上皮细胞数量存在个体差异。
我们的结果表明,本文开发的qPCR方法允许确定远低于使用Neubauer室进行细胞计数获得的范围内的寄生虫数量(阈值限制~10个细胞/μl肠道匀浆物)。使用类似的人工感染方案并在Neubauer室中计数寄生虫,我们观察到在大多数情况下,我们无法检测到消化道不同区段中的任何寄生虫,并且只对寄生虫载量高的昆虫进行计数。这种抽样偏差无法产生可靠的结果来追踪低寄生虫密度(<10^4寄生虫/昆虫)感染的昆虫,这在自然感染中经常观察到。此外,与我们的结果相反,该方法不允许在感染后时间超过十天时检测AM中的寄生虫,并且遗漏了附着在昆虫组织上的寄生虫。
相关新闻推荐
2、重金属胁迫培养对大肠杆菌和枯草芽孢杆菌生长曲线的影响(二)
