线粒体组分分离和呼吸能力评估。 对新鲜分离的线粒体进行氧化磷酸化能力测量和蓝绿原生胶测定,按已发表的方法进行 (52-54),修改为在 8P 平板 (55) 上培养动物,并使用尼龙编织网筛 30、40 和 110 微米来清洁和根据大小分选线虫。
酵母测定。 酿酒酵母单倍体品系均衍生自同基因的 BY4741 MATa 或 BY4742 MATa 背景。缺乏 rip1 的酵母(品系 BW998)从酵母缺失集合中获得,并通过 PCR 确认缺失的存在(Open Biosystems)。固体培养基是 CSM-URA 补充 2%(重量/体积)葡萄糖,通过使每个样品的吸光度相等来标准化细胞数量。将细胞在水中进行五倍系列稀释,并将每种稀释液 4μL 点样到指定的含有 2%(重量/体积)琼脂的固体培养基上。对于液体生长实验,在 CSM-URA 2%(重量/体积)葡萄糖液体培养基中培养过夜培养物,并使用这些过夜培养物的 5μL 接种 145μL 新鲜培养基,该培养基由 1%(重量/体积)酵母提取物、2%(重量/体积)蛋白胨和 2%(重量/体积)葡萄糖组成。使用 Bioscreen C MBR 生长曲线分析仪测定生长速率,如所述 。
结果
分离抑制秀丽隐杆线虫isp-1(qm150)发育迟缓的突变
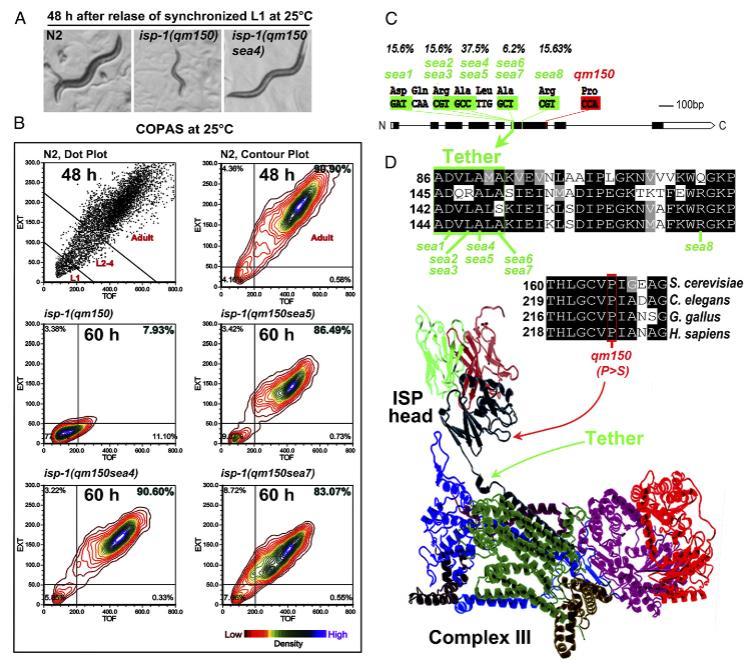
图1. isp-1(qm150)的基因内抑制因子可改善发育迟缓现象,且均位于束缚区域。(A) 在25°C下同步化L1阶段释放48小时后,N2、isp-1(qm150)及其中一种抑制因子的发育情况。(B) 通过复杂对象参数分析分选仪(COPAS)评估在25°C培养48小时(N2)或60小时(isp-1(qm150)及抑制因子株系)的群体个体大小(每株系n=6,000)。N2在48小时检测以防止子代大量污染。(C) isp-1基因结构图,绿色标注抑制突变的位置、残基及发生率,红色标注isp-1(qm150)的P>S突变。(D) 采用ClustalW比对并通过Boxshade呈现酿酒酵母、秀丽隐杆线虫、原鸡和智人的ISP蛋白序列。各片段左侧数字表示首个所示残基的氨基酸编号。功能相同的图1. isp-1(qm150)基因内抑制因子可改善发育迟缓现象,且位于束缚区域。(A) N2、isp-1(qm150)及某一区域(绿色背景标注)的发育情况。细胞色素bc1复合物的带状结构图中箭头指示束缚区域及P>S突变位置。
我们进行了一个正向遗传筛选,以鉴定isp-1(qm150)发育迟缓表型的抑制子(图1A)。在25°C下,isp-1(qm150)纯合子需要大约5天才能达到成年期,而N2(野生型)和抑制子突变体在2-3天内发育到成年期。使用甲磺酸乙酯/N-乙基-N-亚硝基脲诱变,筛选了约50,000个单倍体基因组,并分离出ISP-1内的八个独特的抑制子突变。这些品系与isp-1(qm150)连续回交三次,然后重新评估它们的表型。
为了确定每个抑制子对发育生长速率的相对影响,我们使用流式细胞术在25°C下量化了N2、isp-1(qm150)和抑制子品系的大小(图1B)。L1同步化的N2动物在铺板后约40小时达到成年期,而isp-1(qm150)动物需要约100小时才能发育到成年期。抑制子突变体在L1释放后55-75小时内都能达到成年阶段。
八个独特的基因内抑制子突变中有七个聚集在ISP-1的一个六个氨基酸区域(DQRALA)系链区域,该区域位于isp-1(qm150)品系中P到S突变上游73个残基处(图1C)。位置149(丙氨酸)的突变是我们筛选中最普遍的基因内抑制子突变。
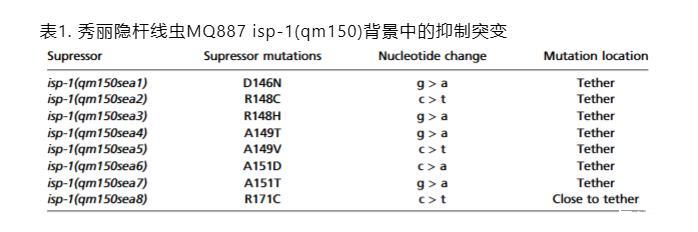
表1.秀丽隐杆线虫MQ887 isp-1(qm150)背景下的抑制子突变
唯一一个在系链之外的基因内抑制子位于系链区域下游20个氨基酸处,sea8,R171(图1 C和D)。ISP蛋白的系链区域是高度保守的(17)(图1D和SI附录,图S1)。由于ISP-1系链区域中的丙氨酸残基高度保守,并且所有抑制子突变体的生长速率相对相似,我们进一步的分析集中在A149T/V(sea4和sea5用于同一残基的比较)和A151T(sea7用于另一残基的比较)上。
isp-1(qm150)发育迟缓的基因内抑制子也抑制繁殖力、运动性和泵送缺陷
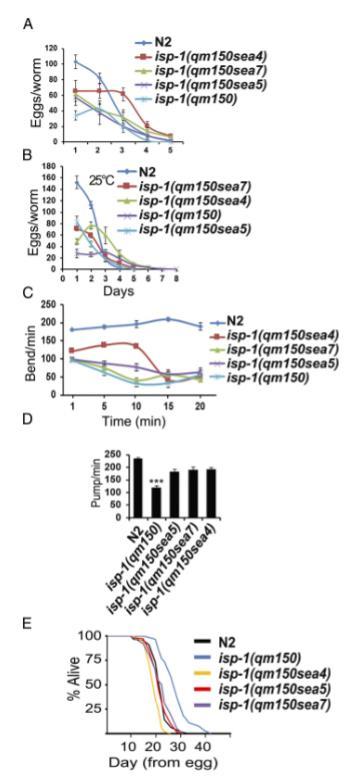
图2. isp-1(qm150)抑制因子的生理参数。(A和B)N2、isp-1(qm150)及其中一个抑制因子在两种不同温度(20℃和25℃)下的繁殖数量,每个品系/条件n=25。(C)20分钟内的摆动次数。(D)咽泵速率,每个品系n=30,采用双尾异方差t检验对所有10种组合进行两两品系比较,以确定哪些泵速率差异具有统计学意义。(E)抑制因子在25°C下的寿命,所示结果为单次典型试验数据。N2(n=90)、isp-1(qm150)(n=65)、isp-1(qm150sea4)(n=53)、isp-1(qm150sea5)(n=158)、isp-1(qm150sea7)(n=198)。图表显示的是在实验过程中死亡的动物。离开琼脂表面的动物不计入统计。未进行其他数据审查。误差棒:突出显示实验的标准误(SEM),*P<0.05;**P<0.01;***P<0.001。
与野生型相比,isp-1(qm150)突变导致繁殖力(繁殖力大小)显著降低(6)。我们在20°C和25°C下测量了携带sea4、sea5或sea7抑制子突变的iso-1(qm150)动物的繁殖力大小,发现所有三个抑制子品系产生的后代都显著多于isp-1(qm150)动物(图2 A)。同样,通过“摆动”(侧向游泳)测定评估,在sup突变体中观察到运动性增加(图2C)。与野生型秀丽隐杆线虫相比,isp-1(qm150)突变还导致咽部泵送速率和运动性显著降低。在所有检查的情况下,抑制子突变导致咽部泵送速率比isp-1(qm150)动物增加(图2D)。
相关新闻推荐
1、短链脂肪酸介导高纤维饮食抑制耐药基因接合转移的分子机制(二)
