2.材料与方法
2.1.微生物
选择蜡样芽孢杆菌、单核细胞增生李斯特菌和大肠杆菌作为产芽孢革兰氏阳性菌、革兰氏阳性菌和革兰氏阴性菌的代表微生物。
蜡样芽孢杆菌INRA-AVTZ415由法国国家农业研究所(INRA,Avignon)kindly提供。单核细胞增生李斯特菌和大肠杆菌型菌株(分别为CECT 4031和CECT 515)由西班牙型菌种保藏中心(CECT)提供。
为了接种生长培养基,蜡样芽孢杆菌营养细胞在30°C下在脑心浸液肉汤(BHI;Scharlau Chemie S.A.,Barcelona,Spain)中培养,直至达到生长稳定期。单核细胞增生李斯特菌营养细胞在37°C下在补充了0.6%酵母提取物(YE;Scharlau Chemie)的胰蛋白酶大豆肉汤(TSB;Scharlau Chemie)中培养,直至达到生长稳定期。大肠杆菌营养细胞在37°C下在酸化至pH 5 with HCl(Panreac Química,Barcelona,Spain)的TSB+YE中培养,直至达到生长稳定期。选择这些生长条件作为这些微生物的有利条件。
2.2.光密度生长曲线
100孔微孔板填充400μL生长培养基(蜡样芽孢杆菌用BHI,单核细胞增生李斯特菌用TSB+YE,大肠杆菌用pH 5 TSB+YE),接种微生物并在Bioscreen C分析仪(Oy Growth Curves Ab Ltd.,Helsinki,Finland)中培养。生长培养基中的初始浓度对于蜡样芽孢杆菌为10¹,10²,10³,10⁴,10⁵和10⁶CFU mL⁻¹,对于单核细胞增生李斯特菌为10°,10°,10°,10°,10°和10°CFU mL⁻¹,对于大肠杆菌为10²,10⁴和10⁶CFU mL⁻¹。为了避免不同培养物生理状态差异引起的变异性,每种细菌的所有生长曲线均来自单一细菌培养物。生长培养基在30°C下培养蜡样芽孢杆菌,在37°C下培养单核细胞增生李斯特菌和大肠杆菌。每20分钟间隔,使用宽带滤波器(420-580 nm)测量样品的光密度(OD)。
对于每种微生物和初始浓度的组合,进行了25-30次重复,除了蜡样芽孢杆菌10¹和10²CFU mL⁻¹初始浓度,分别进行了13和21次重复,以及单核细胞增生李斯特菌10°,10°和10°CFU mL⁻¹初始浓度,各进行了5次重复。通过绘制OD对暴露时间的图获得生长曲线。通过吸光度测量生成了总共345条个体生长曲线。
2.3.平板计数生长曲线
50mL锥形瓶中的生长培养基接种微生物并在500 rpm振荡下培养。生长培养基和培养温度与光密度生长曲线使用的相同。生长培养基中的初始浓度对于蜡样芽孢杆菌为10¹,10³和10°CFU mL⁻¹,对于单核细胞增生李斯特菌和大肠杆菌为10²,10⁴和10⁶CFU mL⁻¹。在预设时间间隔,取样,在缓冲蛋白胨水(BPW,Scharlau Chemie)中适当稀释,并在BHI琼脂(BHIA,Scharlau Chemie)中于30°C培养24小时用于蜡样芽孢杆菌,在胰蛋白酶大豆琼脂(TSA,Scharlau Chemie)+YE中于37°C培养24小时用于单核细胞增生李斯特菌和大肠杆菌。生长曲线进行了重复。
通过绘制log CFU mL⁻¹对暴露时间的图获得生长曲线。
2.4.数学模型
使用五种初级生长模型分析生长曲线。这些生长模型基于线性(源自Monod模型)或非线性(Gompertz、Logistic、Richards和Baranyi)方程(表1),并重新参数化以反映Zwietering等[3]推导的微生物生长参数。
三相线性、Gompertz、logistic和Richards模型的曲线拟合使用Matlab 7.0(Math Works,Natick,USA)的曲线拟合工具进行,计算了生长参数的95%置信限(CL)以及拟合的r²、RMSE和平方和误差(SSE)。
Baranyi方程的曲线拟合使用DMFit 2.0程序进行,并使用了Baranyi和Roberts[23]的模型,由József Baranyi博士kindly提供。该程序提供了每个生长参数的标准误差以及拟合的r²和标准误差。利用这些值,计算了生长参数的95%CL和拟合的RMSE。
使用StatGraphics(StatPoint Technologies,Warrenton,USA)进行方差分析、中位数和箱线图四分位数计算。p值始终低于0.05。
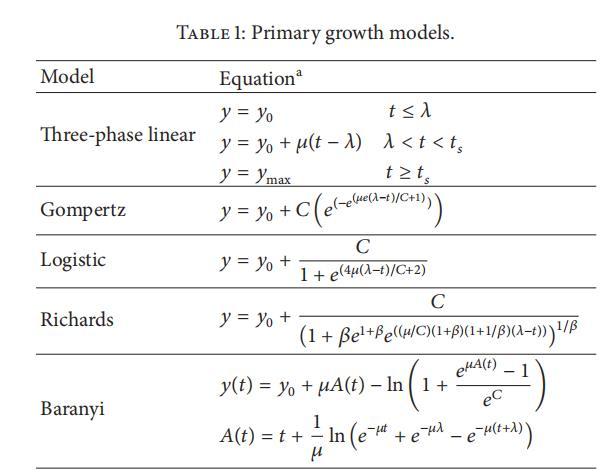
表1:初级生长模型。
a y:时间t时的对数计数或吸光度;y0:初始对数计数或吸光度;μ:最大生长率;λ:延迟时间;tₛ:达到稳定生长阶段的时间;ymax:最终对数计数或吸光度;C:从y0到ymax的对数计数或吸光度增加;β:模型系数。
相关新闻推荐
1、测定代表性排放路径等级下噬藻体生长曲线、感染力指标——讨论、结论
2、转录组技术分析产紫篮状菌抑制尖镰孢菌生长的作用机制——结果与分析
