1.3 实验方法
1.3.1 菌悬液与低浓度微酸性电解水的制备
将副溶血性弧菌划线到3%氯化钠TSA平板上获得单菌落,挑取单菌落于3%氯化钠TSB肉汤中37摄氏度振荡培养18小时。用0.85%的生理盐水洗涤并调整菌悬液浓度至108 CFU/毫升。同时,通过电解水发生器电解0.1%氯化钠和0.01%盐酸溶液制备后稀释得到低浓度微酸性电解水,立即测定其有效氯浓度、pH值与氧化还原电位值。
1.3.2 低浓度微酸性电解水对纯培养菌悬液的处理
将1毫升菌悬液加入到9毫升不同浓度的低浓度微酸性电解水中,处理30秒后用0.5%硫代硫酸钠中和剂终止杀菌。然后用生理盐水进行梯度稀释,从适宜梯度中取0.1毫升涂布于硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂平板或铁琼脂平板进行细菌计数。无菌去离子水处理作为空白对照。
1.3.3 虾样品的接种及低浓度微酸性电解水对接种虾的处理
参照王等方法,将虾沸水浴20分钟,灭活虾体内的原生细菌。待虾冷却到室温,将1毫升不同菌悬液分别滴加于虾的背部和腹部,静置附着20分钟。接种浓度约为7 lgCFU/克。接种后,将虾放入180毫升低浓度微酸性电解水中,分别浸泡0.5、1、3、5、10分钟。处理结束后,将虾转移至中和剂中均质2分钟,如1.3.2节所述进行细菌计数。未处理的接种虾作为对照组。
1.3.4 微生物生长曲线
将不同处理后的副溶血性弧菌和腐败希瓦氏菌菌悬液按照10%接种量添加于3%氯化钠TSB和LB肉汤中,培养温度分别设置为37摄氏度和25摄氏度,用微生物生长曲线分析仪每隔1小时测定1次OD600nm值,总运行时长为24小时。每组3个平行。以培养时间为横坐标,OD600nm为纵坐标,绘制微生物生长曲线。
1.3.5 膜电位测定
细菌膜电位的测定参照Fadhel等方法。在不同处理后的菌悬液中加入1微摩尔/升荧光染料DIBAC4,黑暗中孵育20分钟,使用多功能酶标仪检测荧光强度,激发/发射波长为492/515纳米。
1.3.6 电导率的变化
将不同处理后的菌悬液在12000转/分钟条件下离心3分钟,收集上清液,然后使用水质检测仪测定其电导率。
1.3.7 细菌胞内物质渗漏量测定
将不同处理后的菌悬液在12000转/分钟条件下离心3分钟,收集上清液。使用紫外可见分光光度计测定OD260nm表示DNA含量。蛋白质含量采用Bradford蛋白浓度测定试剂盒测定。K+浓度使用火焰原子吸收光谱仪测定766.5纳米处的吸光度。
1.3.8 细胞内活性氧水平测定
活性氧检测试剂盒测定细胞内活性氧水平。在低浓度微酸性电解水处理前,先将细菌悬液在12000转/分钟条件下离心3分钟,将细胞悬浮于10毫摩尔/升DCFH-DA溶液,37摄氏度孵育20分钟。再用无菌生理盐水清洗,去除多余的DCFH-DA。
1.3.9 细菌内ATP含量测定
将不同处理后的菌悬液在12000转/分钟条件下离心3分钟,弃上清液,加裂解液破碎细菌,离心取上清液,按照ATP检测试剂盒说明测定ATP浓度。
1.3.10 扫描电子显微镜观察
将不同处理后的菌悬液于8000转/分钟条件下离心5分钟,弃上清液。所得沉淀用2.5%的戊二醛溶液悬浮后固定10小时,用无菌生理盐水洗涤3次后,分别用30%、50%、70%、90%、100%乙醇梯度脱水后重悬,取适量样品滴至导电硅片上,二氧化碳临界点干燥后固定喷金,在扫描电镜下观察菌体形态。
1.3.11 激光共聚焦显微镜观察
将不同处理后的菌悬液于8000转/分钟条件下离心5分钟,弃上清液后悬浮至无菌生理盐水中。向每1毫升细菌悬液中加入3微升SYTO 9/PI的2X染料,在黑暗中孵育15分钟。滴加5微升在载玻片上,使用激光共聚焦显微镜观察荧光并拍照分析。SYTO 9和PI染料的激发/发射波长分别为485/540纳米和535/610纳米。
1.4 统计分析
所有实验均为3次重复,结果以平均值±标准偏差表示。采用SPSS 20.0软件对数据进行单因素方差分析,采用Duncan法进行显著性分析,差异显著水平;采用Origin 2022软件作图。
2 结果与分析
2.1 低浓度微酸性电解水对纯培养副溶血性弧菌和腐败希瓦氏菌的杀灭效果
不同有效氯浓度的低浓度微酸性电解水的理化性质及对副溶血性弧菌和腐败希瓦氏菌的杀灭情况如表1所示。相比于对照组,有效氯浓度为0.5、1、2毫克/升的微酸性电解水处理后,副溶血性弧菌分别减少了1.93、4.03、5.29 lg CFU/毫升,而腐败希瓦氏菌分别减少了0.59、1.17、2.8 lg CFU/毫升。当有效氯浓度为4、8毫克/升时,副溶血性弧菌和腐败希瓦氏菌相继被杀灭至未检出水平,可知低浓度微酸性电解水对副溶血性弧菌的杀菌效果更显著。并且随着有效氯浓度增加,两种菌的细菌数量均显著下降,说明有效氯浓度是影响杀菌效果的主要因素。与先前的报道结果一致,有效氯浓度越高,低浓度微酸性电解水对大肠杆菌、沙门氏菌以及铜绿假单胞菌的杀菌活性也越强。
2.2 低浓度微酸性电解水处理对虾表面接种菌的杀菌效果
低浓度微酸性电解水对接种了副溶血性弧菌和腐败希瓦氏菌的海虾进行不同时间的处理,结果如图1所示。与对照组相比,杀菌效果随着处理时间的延长而显著增强。当处理时间为10分钟时,副溶血性弧菌和腐败希瓦氏菌的微生物数量分别下降了1.6、1.25 lg CFU/克。低浓度微酸性电解水杀灭含有机物质的食品基质中的微生物时,低浓度微酸性电解水中的有效作用成分在有机物质作用下会产生损耗,故海虾表面接种菌与纯培养细菌杀灭效果差异较大。
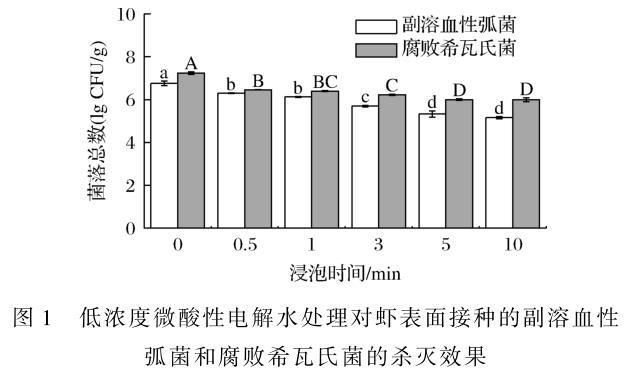
图1 低浓度微酸性电解水处理对虾表面接种的副溶血性弧菌和腐败希瓦氏菌的杀灭效果
注:不同处理中不同大写或小写字母表示差异显著。
2.3 低浓度微酸性电解水处理对细菌生长的影响
通过测定生长曲线进一步评估了低浓度微酸性电解水对2种菌的抑制作用,结果如图2所示。在对照组中,副溶血性弧菌与腐败希瓦氏菌都经过2小时迟缓期后迅速进入对数生长期,随后在13小时和14小时达到稳定期。随着有效氯浓度的增加,两种菌的迟缓期都明显延长,并且最终细菌浓度都相应降低。值得注意的是,在有效氯浓度为10毫克/升时腐败希瓦氏菌被完全抑制生长,而有效氯浓度为6毫克/升时即可彻底杀灭副溶血性弧菌,与平板计数结果一致。李等报道有效氯浓度为12毫克/升的低浓度微酸性电解水可在30秒内完全杀灭单核细胞增多性李斯特菌,说明不同的细菌对有效氯浓度敏感性存在一定差异。
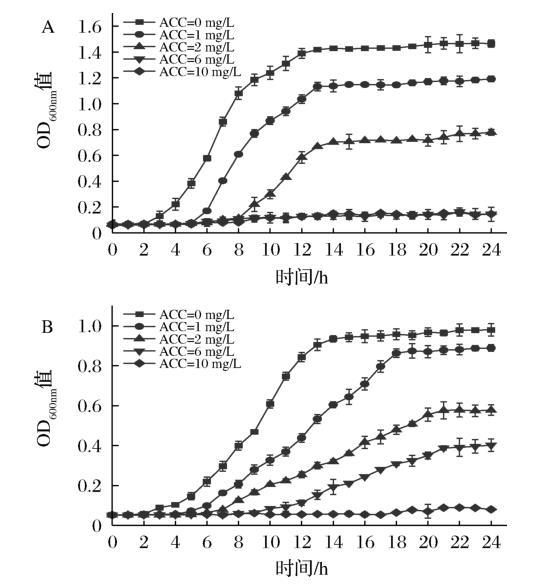
A-副溶血性弧菌;B-腐败希瓦氏菌
图2 低浓度微酸性电解水处理对副溶血性弧菌和腐败希瓦氏菌生长的影响
相关新闻推荐
1、小肠结肠炎耶尔森氏菌烈性噬菌体分离鉴定、生长曲线及应用潜力——材料与方法
2、纳米ZnO-Ag复合材料对小麦根腐菌菌丝生长、种子萌发和幼苗生长影响(二)
