巨噬细胞实验
进行J774巨噬细胞的体外毒力测定,以确定巨噬细胞吞噬和杀死巴西利亚孢子丝菌酵母的能力,以及这种相互作用后巨噬细胞的活力。将J774系巨噬细胞在培养板中单层生长,培养基含有10%胎牛血清、10%NCTC-109、1%非必需氨基酸和1%青霉素/链霉素,稀释于Dulbecco改良Eagle培养基中,于37°C,10%CO2条件下培养,并分装到96孔板中。将5株巴西利亚丝孢酵母菌的酵母细胞,预先用豚鼠血清补体调理30分钟,以5:1的比例加入巨噬细胞单层。
体内实验
为了评估体内毒力,使用25μL Hamilton®注射器给大蜡螟幼虫接种10^4、10^6或10^7个5株巴西利亚孢子丝菌分离株之一的酵母(稀释于10μL PBS中),并分析幼虫存活率。作为对照,一组幼虫接种巴西利亚孢子丝菌参考菌株(CBS120339)。阴性对照组包括未接种的幼虫("Control")和注射10μL无菌PBS的幼虫("PBS")。这些实验在不同日期进行了三次重复。每组由20只幼虫组成,在90 mm培养皿中于37°C下维持,每天评估大蜡螟。在第0天(接种日)和第2天(接种后48小时)对组进行拍照。死亡的幼虫(通过缺乏主动或触摸诱导的运动且通常颜色变深来识别)从组中移除并丢弃。获得生存曲线以比较分离株对幼虫的影响。
在相同条件下平行设置每组10只幼虫用于CFU测定。在接种后3天或6天处死每组3只幼虫。将内部内容物研磨并在2 mL PBS中匀浆,然后通过40μm细胞滤网过滤。取100μL匀浆液涂布于含有0.4 g/L放线菌酮和1%青霉素/链霉素的BHI琼脂上以防止污染,并在37°C下孵育。五天后测定CFU。
推定毒力因子的体外产生
a.脲酶
为了验证脲酶的产生,将相当于2.0麦氏比浊度的各分离株酵母细胞悬浮液0.5 mL接种于4.5 mL Christensen尿素肉汤中,并在37°C下孵育。在4天和7天后,将试管在1,575 g下离心,并将100 uL上清液一式三份转移到96孔聚苯乙烯平底板中。新型隐球菌(ATCC32045)和近平滑念珠菌(ATCC22019)分别用作阳性和阴性对照。使用Biotek分光光度计在559 nm波长下获得样品吸光度。
b.蛋白酶
蛋白酶活性的测量如下所述,使用以下混合物:2%琼脂,15 mM葡萄糖,13 mM甘氨酸,29.4 mM KH2PO4,10 mM MgSO4,3 mM硫胺素,0.1%azoalbumin(pH 4.5)。对于蛋白琼脂清除试验,将各分离株的酵母细胞通过穿刺接种于该混合物上,并在37°C下孵育21天。孵育后,检查菌落周围是否产生azoalbumin降解晕圈。当观察到蛋白水解活性时,用毫米尺测量菌落直径和azoalbumin降解晕圈直径,并计算p/z值作为两个直径的比值。
c.黑色素
根据Almeida-Paes等人描述的方法获得黑色素"幽灵"。然后通过简单的DHN-黑色素/酵母干重比计算每个分离株的二羟萘黑色素比例。
耐热性
将5株分离株的酵母在37°C的BHI肉汤中生长,3天后,将2 mL酵母溶液离心,重悬于PBS中,并进行10倍稀释以获得3种不同稀释度。将2.5μL液滴接种于BHI琼脂平板上,并在35、37或39°C的培养箱中孵育。在3天和6天后,检查平板以定性确定是否存在菌落生长。
生长曲线
将5株分离株的巴西利亚孢子丝菌酵母细胞在37°C的BHI肉汤中生长3天。根据Medina等人描述的方法稍作修改,使用Bioscreen C全自动微生物生长曲线分析仪连续评估浊度作为生长的测量指标。使用制造商提供的Easy Bioscreen Experiment软件记录数据。
对氧化剂的敏感性
将每株分离株的真菌细胞(1 x 10^7酵母)在37°C的BHI琼脂斜面上生长5天后收获,用PBS洗涤3次,并提交给化学产生的一氧化氮、活性氮中间体和氧衍生氧化剂,如先前所述。在37°C下与氧化剂孵育1、2、3和4小时后,将酵母涂布于平板计数琼脂上,通过CFU计数确定存活性。未处理的细胞等分试样也作为对照涂布。每个分离株在某个时间点的存活率是该时间点的CFU计数/对照CFU计数的比值,以百分比表示。
抗真菌药敏试验
根据临床和实验室标准研究所方案使用分生孢子进行药敏试验。使用CLSI描述的用于丝状真菌(包括申克孢子丝菌)的微量肉汤稀释法M38-A2,研究了5株分离株对两性霉素B、酮康唑、伊曲康唑、伏立康唑和特比萘芬的敏感性(0.016-8μg/mL)。将细胞稀释于RPMI 1640中,最终浓度为2 x 10^4至1 x 10^5细胞/mL。对于两性霉素B、伊曲康唑和伏立康唑,最低抑菌浓度终点是完全抑制生长的最低浓度。对于酮康唑,MIC是使生长减少50%的最低浓度,对于特比萘芬,是使生长减少至少80%的最低浓度。
统计检验
在分析中使用非参数检验(例如,Kruskal-Wallis检验比较生长曲线和CFU,Kaplan-Meier估计量用于大蜡螟存活率,Log-rank检验用于比较生存曲线)来比较5株分离株,P值<0.05被认为具有统计学意义。使用GraphPad Prism 6 for Windows,GraphPad Software,Inc.进行图表构建和统计。使用Microsoft Excel 2010/2013进行百分比计算和分析。
结果
分子鉴定
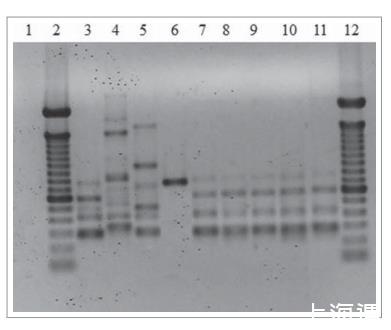
5株分离株的T3B PCR指纹图谱显示300至800 bp的DNA片段,通过与巴西利亚孢子丝菌模式菌株获得的图谱相似性可以清晰鉴定(图2)。此外,所有患者分离株产生的图谱呈现100%相似性。
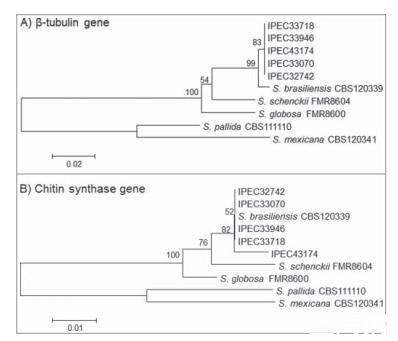
通过BLAST分析将分离株的β-微管蛋白和几丁质合成酶序列与NCBI GenBank数据库中的序列进行比较,将这些分离株鉴定为巴西利亚孢子丝菌,相似性为99-100%。此外,将所有分离株的部分β-微管蛋白和几丁质合成酶序列与GenBank数据库中可用的孢子丝菌复合体参考菌株进行比较和系统发育分析,结果显示与巴西利亚孢子丝菌相似,并且两个基因均显示出高bootstrap支持值(图3A和B)。分离株5的部分几丁质合成酶序列与前4株分离株相比有一个2-bp的多态性(位置109 A/C和151 G/C),表明该分离株在系统发育分析中存在变异性。获得的β-微管蛋白和几丁质合成酶编码基因序列已存入GenBank数据库,登录号为KM222420至KM222429。
体外实验
为了表征其毒力,进行了使用J774巨噬细胞的体外实验,包括吞噬作用、真菌杀灭和巨噬细胞活力测定。有趣的是,分离株之间没有发现差异,使用巴西利亚孢子丝菌模式菌株获得了类似的结果。酵母与巨噬细胞相互作用2小时后的吞噬指数范围从分离株5的89%到分离株4的95%,巨噬细胞无法抑制巴西利亚孢子丝菌的生长,18小时后的真菌存活率在96%至123%之间变化。在此时间点后,所有条件下巨噬细胞活力约为90%(范围从分离株5的89%到分离株3的92%)。
相关新闻推荐
1、高密度发酵的过程中乙酸抑制重组大肠杆菌生长及外源基因的表达——讨论、结论
2、河南省猪流行性腹泻病毒(PEDV)流行毒株的遗传变异、生长特性及灭活疫苗研制研究(一)
