1 材料与方法
1.1 菌株及培养条件
猪源巴氏链球菌WUSP067由本课题组保存,分离自患脑膜炎的断奶仔猪脑部。巴氏链球菌在THB(Todd-Hewitt Broth)液体培养基或THB固体培养基中于37 ℃培养箱(5% CO2)或摇床(180 r·min-1)中培养,需要时添加终浓度为100 μg·mL-1的壮观霉素(spectinomycin,Spc); 测定细菌对糖的利用时用无糖的DMEM(Dulbecco's modified Eagle medium)培养基,需要时加入10 g·L-1的葡萄糖(glucose,Glu)或10 g·L-1纤维二糖(cellobiose,Cel)。
1.2 主要试剂和试验动物
THB培养基购自青岛海博生物公司; 绵羊血购自北京鼎国生物科技有限公司; DMEM培养基购自美国Thermo Fisher Scientific公司; 2× Rapid Taq Master Mix、2× Phanta Flash Master Mix、Taq Pro Universal SYBR qPCR Master Mix、逆转录试剂盒(HiScript Ⅱ QRT SuperMix)、胶回收试剂盒(FastPure Gel DNA Extraction Mini Kit)购自南京诺唯赞生物科技有限公司; SPF级ICR仔鼠(18日龄)购自斯贝福生物技术有限公司。
1.3 生物信息学分析
利用NCBI网站中tBLASTn方法,以肺炎链球菌(NZ_AKBW01000001.1)为参照,分析纤维二糖利用基因簇CN52_RS0111090—CN52_RS0111095和CN52_RS0100970—CN52_RS0101000中各个基因编码氨基酸序列与WUSP067的同源性,评判标准为覆盖率超过70%,氨基酸同源性超过30%。比对结果利用Chiplot网站绘图。
1.4 RT-PCR测定基因共转录
利用Oligo软件设计引物,由南京擎科生物科技有限公司合成,引物信息见表1。引物1-1-F/R、1-2-F/R、1-3-F/R、1-4-F/R分别用于确定E8M05_RS06225—E8M05_RS06230、E8M05_RS06235—E8M05_RS06250、E8M05_RS06250—E8M05_RS06255是否在同一个转录本上; 引物1-5-F/R、1-6-F/R、1-7-F/R、1-8-F/R分别用于确定E8M05_RS011050—E8M05_RS06265、E8M05_RS06265—E8M05_RS06270是否在同一个转录本上。挑取WUSP067单菌落于THB液体培养基中,37 ℃、5% CO2条件下培养至D600值为0.6,提取细菌总RNA,用反转录试剂盒反转录500 ng RNA成cDNA。用上述引物检测反转录生成的cDNA,以提取的RNA为阴性对照。RT-PCR反应体系:2× Rapid Taq Master Mix 12.5 μL,10 μmol·L-1上、下游引物各1.0 μL,ddH2O 9.5 μL,模板1.0 μL。反应条件:95 ℃ 3 min; 95 ℃ 15 s,50 ℃ 15 s,72 ℃ 30 s,30个循环; 72 ℃ 5 min。反应结束后用10 g·L-1琼脂糖凝胶进行电泳,通过凝胶成像仪观察扩增产物大小。
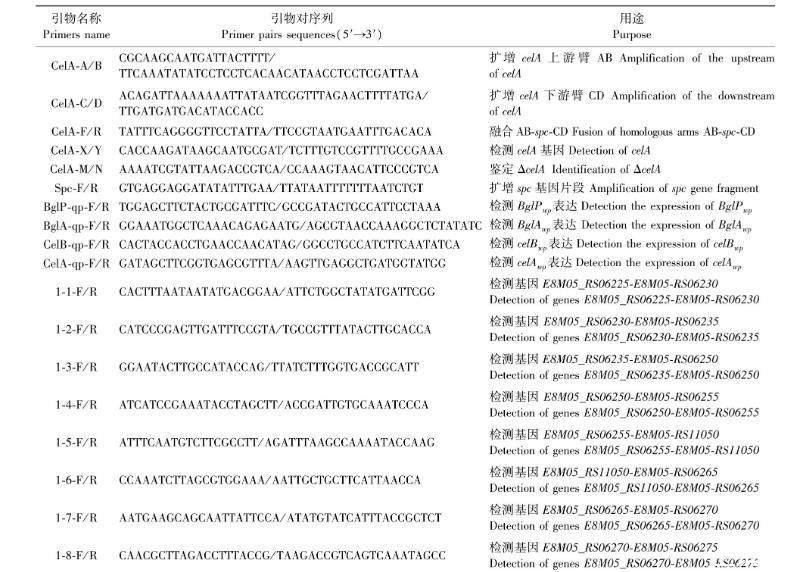
表1 引物序列
1.5 RT-qPCR检测纤维二糖基因簇相关基因表达水平
1.5.1 引物设计
利用网站Integrated DNA Technologies设计检测巴氏链球菌WUSP067纤维二糖基因簇的RT-qPCR的引物,由南京擎科生物有限公司合成,引物信息见表1。
1.5.2 样品制备
挑取WUSP067单菌落接种于THB液体培养基中,37 ℃、180 r·min-1下培养至D600值为0.6; 4 ℃、5 000 r·min-1 离心5 min,弃上清液,PBS清洗1次。分别用含10 g·L-1Glu和10 g·L-1 Cel的DMEM培养基重悬至D600值为0.6,37 ℃、180 r·min-1 培养2 h。提取细菌总RNA,再用反转录试剂盒反转录为cDNA,将所得的cDNA稀释10倍,于-20 ℃保存。每个处理组3个生物学重复。
1.5.3 RT-qPCR
以稀释后的cDNA为模板,使用表1中的引物进行RT-qPCR。反应体系:2 × Taq Pro Universal SYBR qPCR Master Mix 10.0 μL,10 μmol·L-1上、下游引物各0.4 μL,ddH2O 8.2 μL,模板1.0 μL。阴性对照为ddH2O,内参基因为gyrA。RT-qPCR反应条件:95 ℃ 30 s; 95 ℃ 10 s,60 ℃ 30 s,40个循环; 95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。采用2-ΔΔCt方法分析基因的相对表达水平。
1.6 缺失株ΔcelAwp的构建
巴氏链球菌缺失株的构建参照文献,引物由南京擎科生物有限公司合成,引物信息见表1。筛选壮观霉素耐受基因,构建有痕缺失株。以WUSP067基因组为模板,以引物CelA-A/B分别扩增待缺失基因的上游臂celA-AB。以引物CelA-C/D分别扩增待缺失基因的下游臂celA-CD,以Spc-F/R为引物扩增spc片段。以上、下游同源臂AB、CD和spc为模板,以CelA-F/R为引物进行融合PCR。反应条件:95 ℃ 5 min; 95 ℃ 15 s,50 ℃ 30 s,72 ℃ 3 min,30个循环; 72 ℃ 10 min。经PCR得到的3段融合产物,通过 10 g·L-1 琼脂糖凝胶电泳分离,切胶后用DNA片段回收试剂盒回收celA-AB-spc-CD片段。挑取WUSP067单菌落于37 ℃、180 r·min-1 摇床中培养至细菌生长对数期,以1:100(体积比)转接5 mL THB液体培养基中至D600值为0.02~0.07(约40 min)。取100 μL菌液,加入5 μL信号肽(IVLTGWWGV,250 μmol·L-1),加入1.0 μg 融合片段celA-AB-spc-CD,于37 ℃下静置培养2 h后涂布TS平板(含100 μg·mL-1 spc的THB固体培养基)。次日挑取单菌落,用引物CelA-X/Y和CelA-M/N分别鉴定有痕缺失株ΔcelA。以鉴定结果为阳性的菌液为模板,使用引物CelA-A/D扩增片段,送生物公司测序并分析测序结果。
1.7 WUSP067和ΔcelAwp菌株生长曲线的测定
1.7.1 在THB培养条件下的生长曲线
挑取巴氏链球菌WUSP067和缺失株ΔcelAwp单菌落于37 ℃、180 r·min-1 下培养至对数生长期,以1:100(体积比)转接至10 mL THB液体培养基(50 mL锥形瓶)。每隔1 h 测量D600值。每个菌株3个生物学重复,分别绘制各菌株生长曲线。
1.7.2 在添加10 g·L-1Glu或10 g·L-1 Cel的DMEM培养条件下的生长曲线
挑取WUSP067和缺失株ΔcelAwp单菌落于37 ℃、180 r·min-1摇床中培养至对数生长期,5 000 r·min-1离心5 min,弃培养基,PBS清洗 1次,用等量的DMEM重悬后以1:100(体积比)转接5 mL DMEM+10 g·L-1 Glu或10 g·L-1Cel(纤维二糖)液体培养基中(10 mL EP管),37 ℃、180 r·min-1摇床中培养,每隔2 h测量D600值。每个菌株3个生物学重复,分别绘制各菌株生长曲线。
1.8 小鼠毒力试验
采用18日龄ICR级SPF仔鼠,在南京农业大学实验动物中心[许可证号SYXK(苏)2021-0086]开展毒力试验。每个试验组10只小鼠。正式攻毒前先复壮菌株:挑取WUSP067野生株与缺失株ΔcelAwp单菌落接种于THB液体培养基中; 37 ℃、180 r·min-1 培养至D600值约为0.8,4 ℃、5 000 r·min-1 离心5 min,弃上清液,PBS清洗1次,用200 μL PBS重悬,腹腔注射小鼠1只,菌量为3 ×108 CFU。10 h后脱颈处死小鼠,心脏取血,取少量血液划线THB固体培养基,37 ℃、5% CO2条件下培养10 h。挑取单菌落,接种培养至对数生长期,经PCR鉴定为目的菌株。将鉴定正确的WUSP067野生株与缺失株ΔcelAwp转接THB液体培养基,37 ℃、180 r·min-1 培养至D600值约为0.6,取9 mL菌液,4 ℃、5 000 r·min-1 离心5 min,用PBS清洗1次,使用3 mL PBS重悬后采用腹腔注射的方式攻毒,每只小鼠注射200 μL,攻毒菌量3×108 CFU,以注射PBS组作为阴性对照。攻毒后每天观察并记录小鼠死亡情况,共观察14 d,绘制存活曲线。
1.9 数据处理与分析
RT-qPCR和生长曲线测定的数据用非配对t检验分析其差异显著性; 小鼠毒力试验数据使用 log-rank检验来分析数据差异显著性。
相关新闻推荐
1、枯草芽孢杆菌LBD-1形态特征、生长曲线、抗逆性及发酵后饲料特性(三)
