1.2.2噬菌体的电镜观察参照Johnson等的研究方法对纯化后的根瘤菌噬菌体进行电镜观察,取浓缩后10μL的噬菌体溶液滴在铜网上沉淀20min,用滤纸片于铜网的侧面将液体小心吸出。随
后将吸干的铜网浸入到10μL磷钨酸(0.2%,PTA)中,对噬菌体染色10s.用干净的滤纸片吸去多余的PTA染色液后,将干燥后的铜网用透射电子显微镜(JEM-1400,JEOL)进行噬菌体的电镜观察。
1.2.3噬菌体的效价(滴度)测定噬菌体效价是指每毫升样品中含有具有侵染活性的噬菌体粒子数,又称噬菌斑形成单位数(plaque-forming unit,PFU)。噬菌体的效价参照Gu等的方法进行:将纯化后的噬菌体用SM缓冲液做10倍连续稀释后,每个稀释度取100μL,分别加入到含有200μL根瘤菌宿主液的试管中,采用双层琼脂平板培养法培养噬菌体,计算噬菌斑个数。试验做3次重复,噬菌体效价的计算取其平均值。选取30——300个噬菌斑的平板用以计算每毫升未稀释原液的噬菌体数(噬菌体效价)。噬菌体效价(PFU·mL-1)=平板上的噬菌斑数/所取样品体积x稀释倍数。
1.2.4噬菌体的最佳感染复数测定噬菌体在感染初期时,颗粒数与潜在的细菌宿主细胞数目的比值即为MOI感染复数(multiplicity of infection,MOI)。参考Lu等研究方法进行根瘤菌噬菌体最佳感染复数的测定,按照不同的噬菌体稀释比例(100、10、1、0.1、0.01和0.001)与生长至对数生长期的根瘤菌混匀后,静置20min,室温下200r·min-1振荡培养4h,10000xg4℃离心20min后,上清悬液过0.22μm滤膜。取过滤的噬菌体液采用双层平板法测定其滴度,试验重复4次,取平均值计算噬菌体的最佳感染复数。
1.2.5噬菌体的一步生长曲线参考Weiss等的方法进行噬菌体一步生长曲线的测定,将处于对数生长期的根瘤菌宿主菌按照相应的最佳感染复数比例与噬菌体混合,室温条件下培养30min,12000 r·min-1离心30s后弃掉上清液,用预先配置好的YMA液体培养基连续洗涤菌体沉淀2次,随即利用5mL液体的YMA培养基悬起沉淀后混匀,迅速放入摇床中28℃进行震荡培养,从放置起开始计时,每间隔10min取出100μL混合液,进行倍比稀释后,按照1.2.3的方法进行效价的测定。以培养时间为横坐标,根瘤菌噬菌体效价的对数值为纵坐标,进行一步生长曲线的绘制,用以计算噬菌体的潜伏期、裂解期和裂解量等生物学特性,其中裂解量的计算公式为:裂解量=裂解末期噬菌体效价/感染初期宿主菌浓度。
1.2.6噬菌体对温度、pH和紫外光敏感性测定参考Ji等研究方法进行噬菌体热稳定性和pH稳定性的测定,取噬菌体液1.0mL于无菌EP管中,分别于不同温度(30、40、50、60、70和80℃)下水浴1h,之后取出并立即置于冰浴中冷却,测定其在不同温度条件下的效价。
pH稳定性测试步骤为:取20μL的噬菌体原液,加入到0.98mL的YMA液体培养基中,在28℃条件下孵育1h.将混合物的pH值用不同缓冲液调至pH3.0——11.0.所用到的缓冲溶液主要包括:50 mmol·L-1柠檬酸缓冲(pH3.0——5.0)、磷酸盐缓冲液(pH6.0——8.0)、Tris-盐酸缓冲液(pH9.0)和碳酸缓冲液(pH10.0——11.0),按照1.2.3的方法进行效价的测定,试验设置3个重复样本。
噬菌体对紫外光敏感性测定方法:取15mL噬菌体原液于直径6cm的灭菌培养皿中,置于紫外灯(20W,30cm)下,分别处理0、3、6、9、12、15、18和21min,每次取样1mL,然后静置在暗处30min,按照1.2.3的方法测定其效价,并计算其存活率。
1.3数据处理
采用Excel 2016进行数据统计分析,采用Sigma Plot12.5进行绘图。
2结果与分析
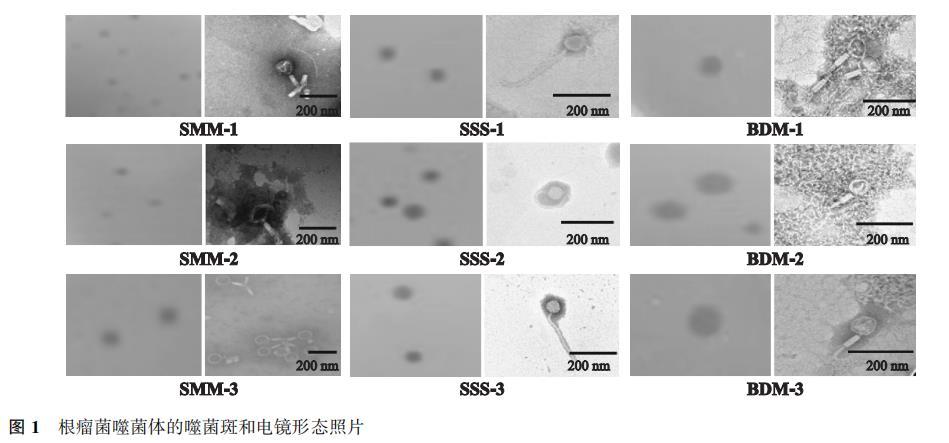
2.1根瘤菌噬菌体的分离与纯化及形态学鉴定
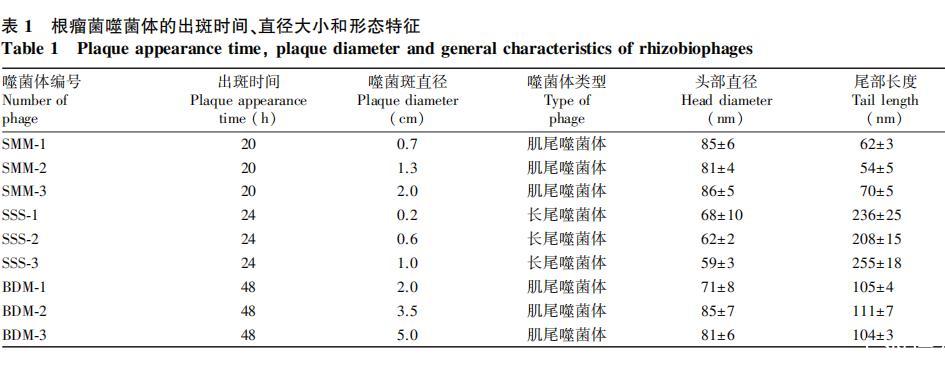
本研究以慢生根瘤菌(USDA110T)、中华根瘤菌(CCBAU05684T)和中华苜蓿根瘤菌(USDA1002T)为宿主,采用双层平板法,分离获得9株根瘤菌噬菌体,其噬菌斑均呈圆形分布、表面清晰透明、边缘光滑平整、没有同心圆噬菌斑的现象(图1)。通过噬菌斑特征鉴定,9株噬菌体均为裂性噬菌体。依据不同宿主分别命名为SMM-1、SMM-2、SMM-3、SSS-1、SSS-2、SSS-3和BDM-1、BDM-2、BDM-3.纯化后的噬菌体经负染后,电镜下的形态结构及噬菌体特征如图1所示。获得的3株苜蓿根瘤菌噬菌体(SMM)和3株慢生型根瘤菌噬菌体(BDM)均为蝌蚪状,头部呈二十面体立体结构,带有可伸缩无弯曲的长尾。其头部大小范围为(71±8)——(86±5)nm,尾部大小在(86±5)——(111±7)nm范围内(表1)。而中华根瘤菌噬菌体(SSS)头部形态近乎于球形,尾部为一个非伸缩性且可弯曲的长尾。其头部直径明显小于SMM和BDM,仅为(59±3)——(68±100)nm,而尾部长度为(208±15)——(236±25)nm,显著高于SMM和BDM噬菌体。根据国际病毒分类委员会制定的分类标准,9株噬菌体都属于有尾噬菌体目(Caudovirales),其中SMM和BDM属于肌尾噬菌体科(Myoviridae),而SSS属于长尾噬菌体科(Siphovi-rideae)。
2.2根瘤菌噬菌体最佳感染复数
获得的噬菌体与相应的根瘤宿主菌悬液按照不同稀释比例混合后,9株噬菌体的最佳感染复数分析结果显示,SMM-1、SMM-2、SMM-3噬菌体和宿主菌悬液比值在0.1、0.01、0.001时的滴度达到最大值,分别为6.3x1010、9.6x1011和3.9x1011 PFU·mL-1;SSS-1、SSS-2、SSS-3分别在0.1、1和0.01的比例时其滴度达到最大值,分别为2.6x1010、9.5x 10°和3.6x1010°PFU·mL-1;而BDM-1、BDM-2、BDM-3分在0.1、0.01和1的比例时滴度达到最大值,分别为5.1x1011、3.5x1011和7.2x1011PFU·mL-1.研究发现,侵染相同宿主的噬菌体滴度达到最大时的最佳感染复数不同。
相关新闻推荐
1、敲除ST2表达对ConA诱导的自身免疫性肝炎(AIH)小鼠肠道菌群的影响
2、新型环状阳离子多肽的从头设计及其对植物病原细菌的抑制作用(一)
3、新筛选PET塑料降解酶表征、降解能力、最佳条件、实际应用(一)
