1.2试验方法
1.2.1菌株初筛
取30 g舍饲基础饲粮的肉鸡粪便,加入带有玻璃珠的150 mL灭菌蒸馏水的锥形瓶中,在转速为200 r/min、温度为30℃的摇床中培养30 min后,取5 mL菌悬液,接种于50 mL灭菌后的富集培养基中,在同上条件的摇床中培养48 h后,取5 mL富集培养液接入新的富集培养基中,如此反复连续富集3次。将富集培养后的菌液按梯度稀释,均匀涂布于YPD固体培养基上,在30℃恒温箱内倒置恒温培养24~48 h。挑取平板上具有不同菌落特征的疑似酵母菌落进行重复划线分离、纯化处理,至所获菌株的形态完全一致后,保藏备用。
1.2.2菌株复筛
将上述纯化后的酵母菌分别接入YPD培养基中,活化培养24 h备用。分别吸取1 mL菌液置于无菌离心管中,在4℃、4 145×g条件下离心10 min后弃上清液,用无菌生理盐水洗涤3次。最后用1 mL无菌生理盐水重悬,制成菌悬液,接入装有100 mL的筛选培养基的锥形瓶中,置于30℃、200 r/min摇床中培养48 h后,通过测定培养基中氨氮含量、酵母菌的生物量、蛋白质含量和总蛋白质得率,分析不同酵母菌的氨氮转化能力。取氨氮利用能力较高的菌株培养液10μL,接入装有190μL液体YPD培养基的100孔板中,将100孔板放入Bioscreen C PRO型全自动生长曲线分析仪中,以YPD液体培养基为空白对照,设置温度为30℃,培养时间48 h,检测波长为600 nm,检测时间间隔为2 h。观察各菌株的生长曲线,最终筛选出生长较快的疑似酵母菌。
1.2.3酵母菌的鉴定及生理生化特性
1.2.3.1菌落及菌体的形态学观察
将疑似酵母菌划线接种到YPD固体培养基上,30℃培养72 h,观察菌落形态。用接种环取适量菌体置于载玻片上,制成水浸片,在生物显微镜下观察菌体的细胞形态。
1.2.3.2分子生物学鉴定
将疑似酵母菌Y-7在YPD琼脂培养基培养后,送至北京擎科生物技术有限公司进行分析鉴定。采用18S rDNA分子鉴定,试验所用引物为真菌通用引物:NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS8(5'-TCCGCAGGTTCACCTACGGA-3')。通过BLAST数据库对测序结果进行比对,搜寻同源序列,再用MEGA7.0软件中邻接法构建系统进化树。
1.2.3.3生理生化试验
将分离纯化好的菌株转到BUY平板上,26℃培养48 h,制备菌悬液接种于YT微孔板,26℃培养72 h。分别在24、48和72 h,使用美国Biolog公司的MicrologTM 3软件采集数据,并进行生理生化特性分析。
1.2.4酵母菌抗逆性对比研究
1.2.4.1耐温性
将酿酒酵母、产朊假丝酵母和酵母菌Y-7的种子液按2%的接种量接入已灭菌的YPD培养基中,分别在不同温度(30、35、40、45和50℃)下静止培养24 h后,取适量酵母菌液于波长600 nm下测定吸光度值,重复3次,取平均值。
1.2.4.2耐酸性
将酿酒酵母、产朊假丝酵母和酵母菌Y-7的种子液按2%的接种量接入pH分别为1、2、3、4、5和6的YPD培养基中,于30℃静止培养24 h后,取适量酵母菌液于波长600 nm下测定吸光度值,重复3次,取平均值。
1.2.4.3耐盐性
将酿酒酵母、产朊假丝酵母和酵母菌Y-7的种子液按2%的接种量接入NaCl浓度为5%、7%、9%、11%和13%的YPD培养基中,于30℃静止培养24 h后,取适量酵母菌液于波长600 nm下测定吸光度值,重复3次,取平均值。
1.3检测指标
菌体生物量的测定:取20 mL发酵液放入预称重的离心管中,在8 000×g条件下离心10 min,将离心得到的沉淀洗涤3次,并于65℃条件烘至恒重,称量并计算菌体生物量。
氨氮降解率的测定:采用苯酚-次氯酸盐法测定上清液的氨氮含量,并计算氨氮降解率:
氨氮降解率(%)=[(初始氨氮含量-上清液氨氮含量)/初始氨氮含量]×100。
菌体蛋白质含量的测定:将烘干的菌体粉碎后,采用中华人民共和国国家标准《饲料中粗蛋白的测定凯氏定氮法(GB/T 6432—2018)》的方法测定菌体蛋白质含量,并计算总蛋白质得率:
总蛋白质得率(g/L)=菌体生物量×菌体蛋白质含量。
1.4数据统计与分析
数据经Excel 2021初步处理后,采用SPSS 26.0软件中one-way ANOVA程序进行方差分析,并用Duncan氏法进行多重比较,结果以平均值±标准差表示。P<0.05为差异显著。采用Graphpad Prism 8.0软件进行绘图。
2结果与分析
2.1酵母菌的筛选
从采集的鸡粪中分离出16株疑似酵母菌,编号分别为Y-1~Y-16。如表1所示,对初筛菌株进行复筛,结果共获得7株氨氮降解率在30%以上的疑似酵母菌。其中,菌株Y-7的生物量、总蛋白质得率和氨氮降解率均显著高于其余6株菌(P<0.05)。菌株Y-6的蛋白质含量显著高于其余6株菌(P<0.05)。
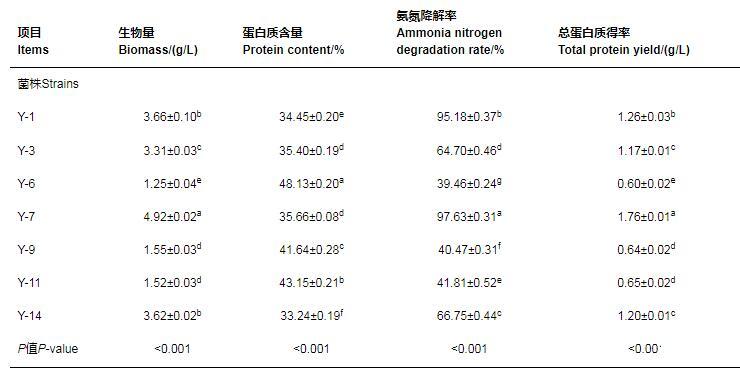
表1筛选酵母菌对氨氮的利用能力
如图1所示,对上述7株菌的生长曲线进行分析,结果发现菌株Y-7生长速度快于其余6株菌,0~2 h处于迟滞期,2~12 h处于对数增长期,12 h后进入平台期。综上所述,复筛出菌株Y-7进行下一步形态学观察和分子生物学鉴定。
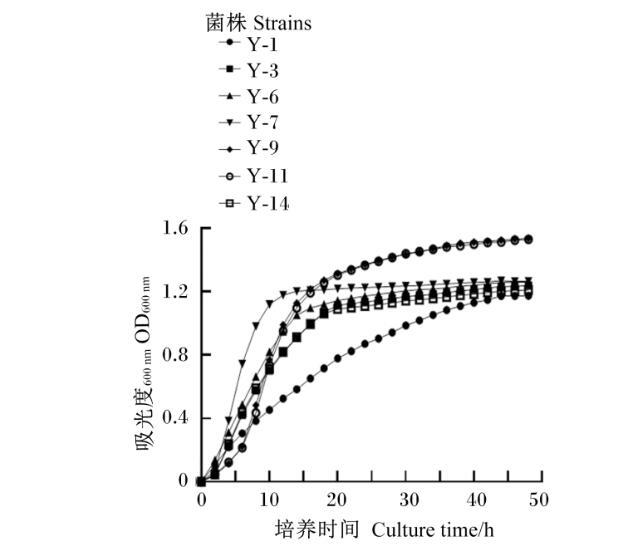
图1筛选酵母菌的生长曲线
2.2酵母菌的鉴定及生理生化特性
2.2.1菌落及菌体形态的观察
如图2-A所示,观察菌株Y-7的菌落的形态特征,菌落呈圆形、白色、光滑、黏稠、边缘整齐。如图2-B所示,进行细胞形态观察,细胞呈卵圆形、椭圆形,单个或双个,大小(1.3~1.9)μm×(3.5~10)μm。
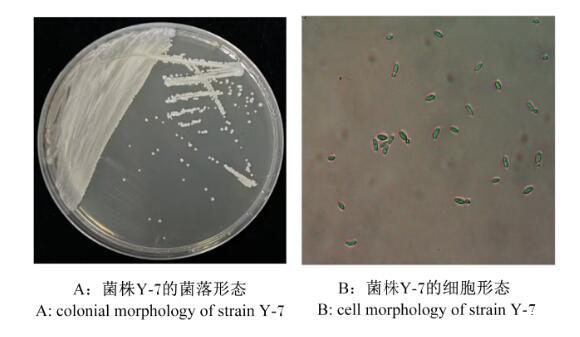
图2菌落及菌体形态的观察
2.2.2酵母菌的分子生物学鉴定
由图3可知,菌株Y-7所测得的18S rDNA序列与已发表的假丝酵母菌属(Candida)相近种模式菌的序列构建了系统发育树,结果显示菌株Y-7与克鲁斯假丝酵母(Candida krusei)NRRL-Y-5396聚在同一分支,亲缘关系最近,结合形态特征,确定菌株Y-7为克鲁斯假丝酵母。
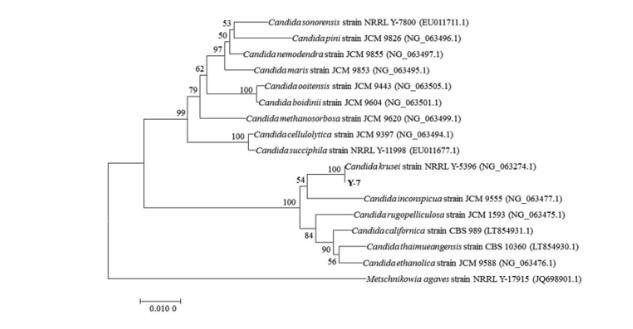
图3基于18S rDNA基因序列菌株Y-7的系统发育树Candida:假丝酵母菌属;Candida krusei:克鲁斯假丝酵母;strain:菌株。
2.2.3酵母菌的生理生化特性
如表2所示,菌株Y-7可以代谢的碳源种类有2种,包括N-乙酰基-D-葡萄糖氨、α-D-葡萄糖;处于边界值的1种(菊糖);不能代谢的有31种。此外,菌株Y-7能够同化的碳源有3种,包括N-乙酰基-D-葡萄糖氨、α-D-葡萄糖、琥珀酸单甲基酯和D-木糖/戊醛糖;处于边界值的有3种,包括L-谷氨酸、甘油、D-木糖;不能同化的有53种。

表2菌株Y-7的碳源利用情况
相关新闻推荐
1、南农大在植物生长促进细菌-植物-微生物组互作关系方面取得新进展
