肠道微生物群竟成抗癌“隐形战士”!《Cell》最新研究揭示,肠道菌群通过羟基类固醇脱氢酶(HSDHs)催化生成多种新型胆汁酸(BAs),其中部分可高效拮抗宿主雄激素受体(AR),激活抗肿瘤免疫。研究整合微生物遗传学与代谢组学,鉴定出56种未被充分表征的BA异构体,并在动物模型中验证其机制:如3-oxo-D4,6-LCA通过抑制AR信号,驱动肿瘤微环境中干细胞样CD8+T细胞的扩增,显著增强抗PD-1疗效,且该效应严格依赖AR通路。这一发现不仅揭示了菌群-宿主互作调控免疫的新维度,更为开发微生物代谢物辅助的癌症免疫疗法开辟全新路径!
摘要
微生物群来源的胆汁酸(BAs)与宿主生物学过程及疾病状态存在关联,但其因果效应仍不甚明确。本研究提出假说:系统解析尚未明确的微生物群衍生BAs,将揭示新型BA感知受体及其生物学功能。通过整合胆汁酸代谢组学与微生物遗传学方法,我们对200余个推定的微生物群BA代谢基因进行功能解析,鉴定出56种特征不明确的BAs,其中多种在人类/哺乳动物体内可检测到。值得注意的是,其中部分BAs可作为人类雄激素受体(hAR)的有效拮抗剂,抑制AR相关基因表达且具有人类生物学相关性。作为原理验证,我们证实其中一种BA能以AR依赖的方式抑制肿瘤进展,并增强抗PD-1治疗的疗效。本研究表明,整合生物信息学、BA代谢组学和微生物遗传学的策略可扩展对微生物群代谢潜能的认知,揭示微生物群BA-AR互作这一意外机制及其在宿主生物学调控中的重要作用。
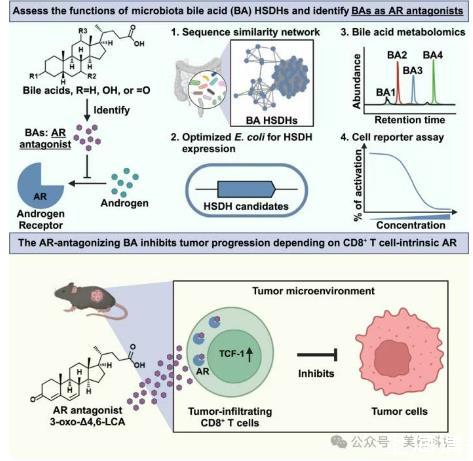
研究背景肠道微生物群通过代谢产生多种小分子代谢物,其中次级胆汁酸(BAs)不仅是传统认知的抗菌剂,更是通过与宿主核受体互作调控免疫与代谢的信号分子。然而,其结构与功能的复杂性带来两大挑战:
(1)鉴定难题:次级BAs存在大量同分异构体(分子式相同、结构不同),导致难以区分和鉴定。(2)功能解析困难:个体间微生物群代谢差异及生物样本中BAs含量有限,阻碍了其分离与功能研究。
研究团队提出:次级BAs的微小结构差异(如羟基位置或立体构型)可能显著影响其与宿主受体(如核受体)的结合能力,从而调控生理或病理过程。为此,他们整合微生物遗传学与代谢组学技术,开发了一种大规模筛选微生物羟基类固醇脱氢酶(HSDHs)的方法,旨在系统解析BA代谢酶的功能及其产物特性。
关键发现:(1)鉴定了多个未被充分研究的BA异构体,其中部分(如3-oxo-D4,6-LCA)是强效的雄激素受体(AR)拮抗剂,可抑制AR依赖的基因表达、肿瘤细胞增殖及AR核转位。(2)在小鼠模型中,3-oxo-D4,6-LCA能抑制肿瘤负荷与转移,并增强抗PD-1免疫治疗的疗效,且此效应依赖于AR信号通路。
主要研究结果
1.肠道菌群羟基类固醇脱氢酶的功能解析与未充分表征的胆汁酸异构体研究
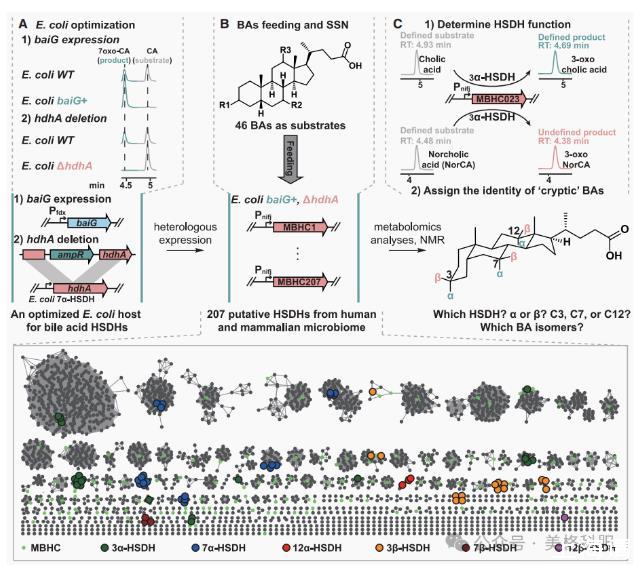
研究人员通过构建一个包含62种已知胆汁酸(BAs)标准品的化学库,并对人类和无特定病原体(SPF)小鼠的粪便样本进行代谢组学分析,发现肠道微生物群产生了多种未被充分表征的胆汁酸异构体。这些异构体在质谱分析中显示出不同的保留时间,但具有相同的分子式和几乎相同的碎片模式。进一步利用同位素标记实验验证了这些异构体的存在及其由微生物转化生成的过程。为了深入研究这些胆汁酸异构体及其代谢基因的功能,研究团队推测这些异构体的结构多样性部分由微生物BA羟基类固醇脱氢酶(HSDHs)驱动,这类酶能够将胆汁酸C3、C7或C12羟基转化为酮基。
相关新闻推荐
1、生长曲线分析仪研究食窦魏斯氏菌生物学共性及抑菌谱特性(二)
2、植物乳杆菌KLDS1.0386的生长曲线及胆盐水解酶产量(二)
