2结果
2.1显微镜观察结果
DHV-1 ZJ-08株在DEF-h细胞中培养24 h后,可以观察到CPE,72 h更明显,主要表现为细胞间隙增宽、拉网、脱落、细胞崩解和死亡等特征,而对照细胞的形态则表现良好的生长形态(图1)。
2.2 RT-PCR检测结果
采用RT-PCR方法检测经DEF-h细胞培养的第3代DHV-1的基因组。结果显示,扩增获得一条长约471 bp的特异性基因片段。该PCR产物的序列测定结果表明该序列与DHV ZJ-08株的基因序列同源性在99%以上。
2.3 IFA检测结果
DHV-1在DEF-h细胞中培养48 h后,经IFA检测结果显示,有大量特异性绿色荧光(图2),表明DHV-1病毒蛋白获得了良好表达。
2.4 Western blot检测结果
采用western blot对感染DHV-1的DEF-h细胞进行免疫学检测,结果显示,在DEF-h细胞裂解物中能够检测到DHV-1 VP1的存在(分子量约26 ku),而且能够与抗VP1的抗体特异性反应(图3),表明表达产物具有良好的免疫原性。
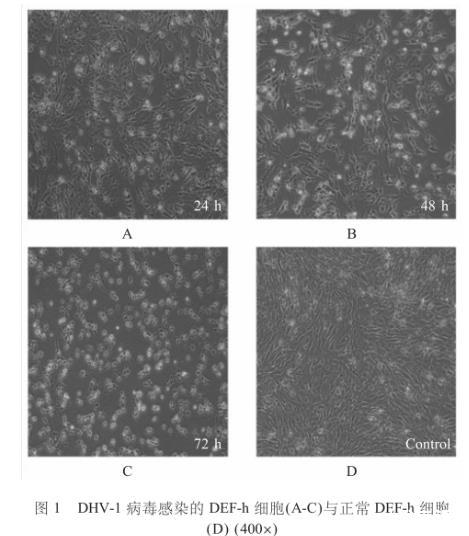
图1 DHV-1病毒感染的DEF-h细胞(A-C)与正常DEF-h细胞(D)(400×)
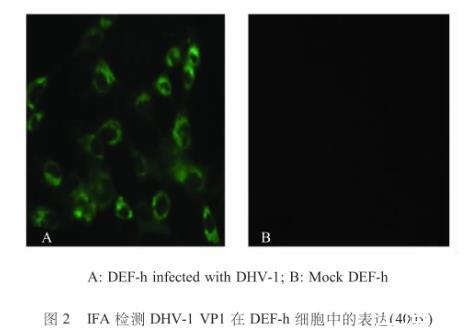
图2 IFA检测DHV-1 VP1在DEF-h细胞中的表达(400×)
2.5鸡胚感染试验结果
将在DEF-h细胞中培养3代的DHV-1接种9日龄鸡胚,观察6 d。结果表明DEF-h细胞中增殖的DHV-1能够致死鸡胚(48 h~96 h),死亡率为80%(12/15),而用鸡胚分离的第5代病毒对鸡胚的致死率仅为40%,提示DHV-1更容易适应DEF-h细胞。
2.6 DHV-1在DEF细胞中的增殖规律
一步生长曲线表明DHV-1在DEF-h细胞中的增殖规律为:DHV-1感染DEF-h细胞后12 h开始增殖,36 h~72 h进入一个快速增殖期,84 h病毒滴度达到峰值,病毒滴度为4.54 TCID50/mL。96 h后,病毒的增殖随着细胞的崩溃而降低(图4)。
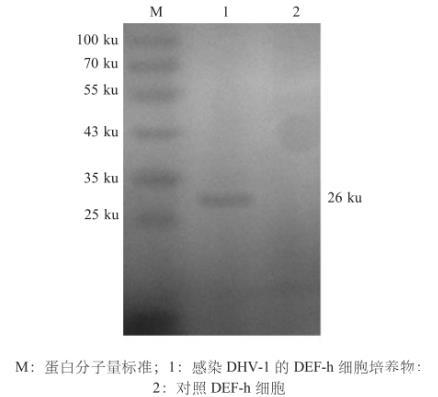
图3 Western blot检测DHV-1 VP1
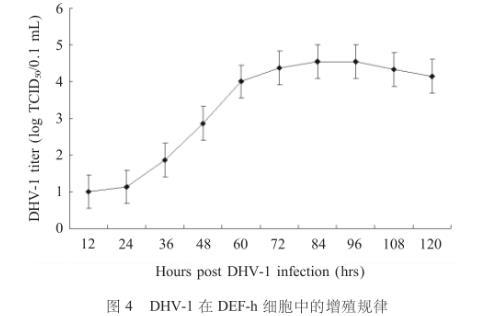
图4 DHV-1在DEF-h细胞中的增殖规律
3讨论
目前,DHV的分离方法为采用SPF鸡胚或鸭胚分离,该方法虽然有效,但国内外研究均表明,DHV-1野毒株通常不易适应在鸭胚或鸡胚的增殖,往往需要盲传3代以上才能分离到病毒。因此,用禽胚直接分离DHV比较费时,而且SPF鸭胚的来源也十分有限,不能随时获得,使得用鸭胚分离DHV-1的方法受到很大限制。为此,本实验室构建了一种永生化的DEF-h细胞系,该细胞系对DHV-1十分敏感,为开展DHV-1的相关基础研究提供了良好的平台。
本研究在建立DEF细胞系的基础上,研究DHV-1在DEF-h细胞系中的增殖特性,为进一步研究DHV-1的致病机理和病毒与宿主之间的相互作用等奠定基础。本研究表明,DHV-1野毒(ZJ-08株)第一代就可以适应DEF-h细胞,而且产生明显的细胞病变(48 h),72 h病毒滴度为4.3 TCID50/mL。在DEF-h细胞中连续增殖3代的DHV-1对鸡胚具有较强的致病性,致死率高于用鸡胚传代5次的DHV-1。表明用DEF-h细胞系分离DHV-1不仅比使用鸡胚或鸭胚分离病毒更便捷、易行,而且为开展DHV-1分子生物学研究提供良好的操作平台。
相关新闻推荐
1、草鱼性腺细胞系生长曲线测定及对鲤春病毒血症病毒敏感性研究(一)
2、微生物生长曲线分析仪应用:筛选赖氨酸高渗透压条件过表达提高生长基因
3、不同浓度的表面活性剂PEG6000、SDS胁迫培养对细菌生长的影响【下】
