1.3.3高渗胁迫处理无菌条件下,用打孔器(直径为7 mm)在01-23和STM-35菌落外缘打取菌盘,然后接种至3种不同山梨醇浓度(1.0,1.5,2.0 mol/L)的DPA培养基平板上,置于恒温培养箱中25℃黑暗培养,以在无山梨醇的DPA培养基上生长的菌株为对照(CK)。
1.3.4菌落、菌丝形态观察及生长速率测定将菌株在高渗固体培养基上培养8 d后,观察菌落形态,采用十字交叉法测量菌落直径,计算抑制率,显微观察菌丝的形态特征及发育情况。
抑制率=(对照菌落直径-高渗处理菌落直径)/(对照菌落直径)×100%。
1.3.5脂类物质沉积的形态学观察将2.0 mol/L山梨醇处理的WT和KO菌株利用油红O染液进行脂肪染色、制片,并在显微镜下观察脂类物质沉积的形态学变化。染色参照陈侃等[17]的方法略作修改,具体步骤:取培养10 d的菌株,向培养皿中加入3 mL无菌水,轻轻刮取菌丝,用双层擦镜纸过滤,滤液经12 000 r/min离心5 min后去掉上清,收集沉淀,用液氮反复冻融5次,转入4%中性甲醛中固定12 h,取出用PBS漂洗后放入60%异丙醇中浸泡30 min,取出后加入50μL油红O染液,黑暗条件下染色24 h,置于60%异丙醇中脱色,显微镜下观察染色情况并照相。
1.4数据统计分析
利用IBM SPSS Statistics(version 19)软件(SPSS Inc.)对试验数据进行ANOVA方差分析。
2结果与分析
2.1玉米大斑病菌高渗胁迫培养基的筛选
由于PDA培养基中马铃薯浸提液中含有盐离子,并且不同马铃薯品种及熬煮时间都可能对其浸提液中盐离子浓度产生影响,从而干扰本试验中高渗胁迫分析结果。而蛋白胨作为一种化学产品,不仅排除了生产工艺的干扰,而且蛋白胨中不含盐离子或盐离子非常少,不会影响本试验中高渗胁迫分析结果,因此本研究采用蛋白胨代替马铃薯浸提液的DPA培养基进行高渗胁迫分析。通过比较WT菌株与KO菌株在PDA和DPA培养基上的菌丝形态,结果发现,在PDA培养基上WT菌株与KO菌株生长菌丝形态有较明显的区别,WT菌株的菌丝细胞内有明显颗粒状内容物出现,而KO菌株的菌丝细胞内无明显颗粒状内容物。在DPA培养基上,WT菌株与KO菌株的菌丝细胞内均有明显的颗粒状物出现,2种菌株的菌丝状态相似。因此,DPA培养基更适于分析STK1基因对渗透胁迫的调控作用。
2.2山梨醇高渗胁迫对玉米大斑病菌菌落生长的影响
山梨醇高渗胁迫对玉米大斑病菌菌落生长速度的影响见图1。
由图1可以看出,在1.0 mol/L山梨醇胁迫条件下,KO菌株与WT菌株的菌落生长速度没有显著差异,但在1.5和2.0 mol/L山梨醇胁迫条件下,KO菌株的菌落生长速度都显著低于WT菌株,表明KO菌株对较高浓度山梨醇的渗透胁迫比WT菌株更敏感。
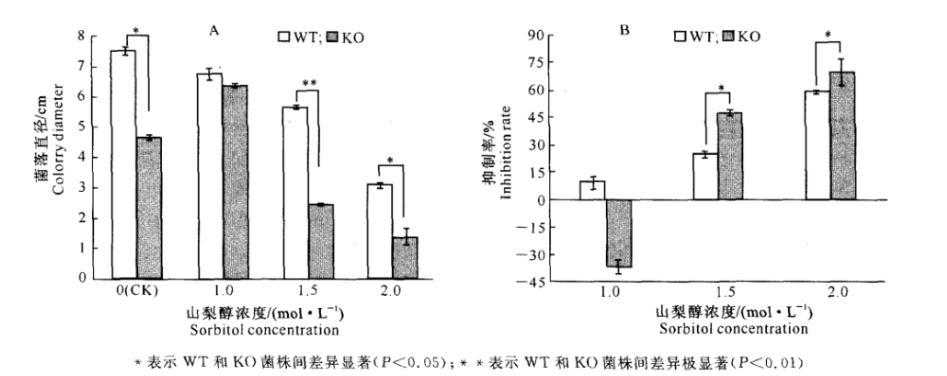
对WT菌株,未加山梨醇和山梨醇浓度为1.0 mol/L的DPA培养基中,WT菌株的菌落生长速度基本上一致;当山梨醇浓度大于1.0 mol/L时,浓度越大,菌落生长速度越慢(图1-A),即高浓度山梨醇对WT菌株菌落生长速度有显著抑制作用。
对KO菌株,在1.0 mol/L山梨醇高渗胁迫条件下,KO菌株的生长速度显著加快,当山梨醇浓度增加到1.5和2.0 mol/L时,菌落生长速度又显著减慢,说明一定浓度山梨醇高渗胁迫对KO菌株的菌落生长速度有促进作用,但高浓度山梨醇却有抑制作用(图1-A)。
由图1-B可以看出,除在1.0 mol/L山梨醇胁迫条件下KO菌株的菌落生长速度得到显著的促进作用以外,其它处理的菌落生长速度均受到显著的抑制作用。在1.5和2.0 mol/L山梨醇渗透胁迫下,KO菌株菌落生长速度的抑制率显著高于WT菌株。
2.3山梨醇高渗胁迫对玉米大斑病菌菌落形态和颜色的影响
在山梨醇高渗胁迫条件下,WT菌株和KO菌株的菌落形态没有显著变化,但菌落颜色变化非常明显。在山梨醇高渗胁迫条件下,WT菌株的菌落颜色由黑色变为灰白色,而KO菌株则在1.5 mol/L山梨醇胁迫条件下菌落颜色变深,在1.0和2.0 mol/L山梨醇胁迫条件下菌落颜色变浅(图2)。
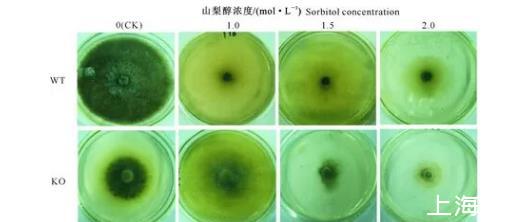
图2山梨醇高渗胁迫对玉米大斑病菌菌落形态和颜色的影响
相关新闻推荐
1、不同盐度下纤毛虫(黄色伪角毛虫和扇形游仆虫)的生长曲线(一)
2、核心微生物群落中稀有物种重要性、持久性的生态驱动因素(二)
