2结果与分析
2.1桑椹菌核病拮抗菌的分离筛选
从‘川桑7637’枝条中分离纯化获得98株内生细菌,初筛结果显示有18株内生细菌对S.sclerotiorum PZ-2有拮抗效果,复筛发现内生细菌C1R32、C3T5、C3N15、C3N16、C1R38、C3R1-2对病原菌PZ-2有较好的抑制效果(图1A),其中C1R32抑菌效果稳定且最佳,抑菌率达66.47%(图1A、1B),因此选择C1R32进行后续研究。
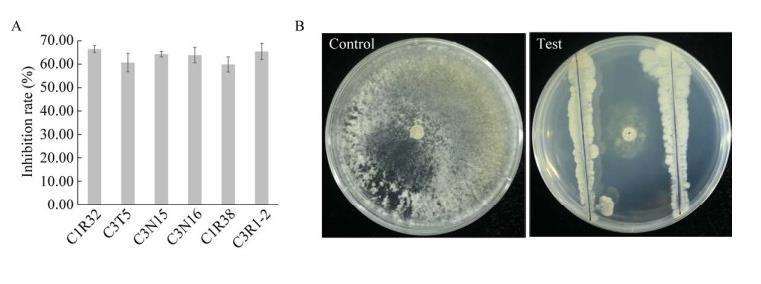
图1 Sclerotinia sclerotiorum PZ-2拮抗菌的复筛结果
2.2桑椹菌核病拮抗菌的鉴定
2.2.1形态学和生理生化特征
C1R32菌株在PDA和LB培养基中37℃培养12 h后,其生长形态无明显差别,均展现出快速生长特性,单菌落隆起,呈饱满的圆形,乳白色,边缘光滑,表面有光泽(图2A、2B);革兰氏染色和芽孢染色结果显示C1R32菌株为革兰氏阳性杆状细菌(图2C),产椭圆形芽孢(图2D);生理生化指标鉴定结果显示C1R32能利用葡萄糖,水解淀粉、明胶,还原硝酸盐,有接触酶,Voges-Proskauer试验呈阳性(表2),参照《常见细菌系统鉴定手册》初步将其鉴定为芽孢杆菌(Bacillus sp.)。
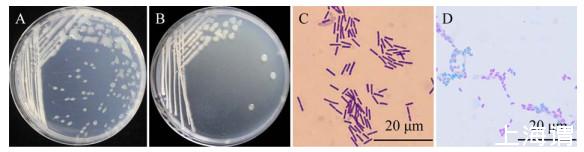
图2 C1R32菌株形态特征
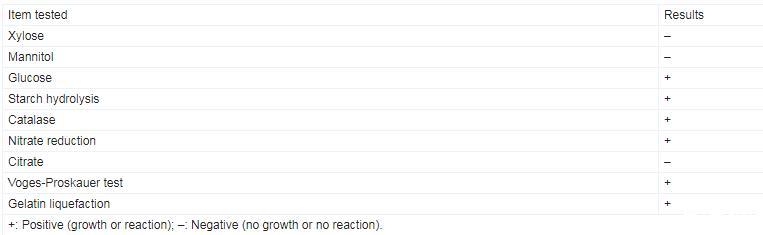
表2.C1R32菌株生理生化特征
2.2.2基于16S rRNA基因序列的系统发育分析
扩增Bacillus sp.C1R32的16S rRNA基因序列,测序获得长为1 397 bp的片段,其在NCBI数据库上BLAST比对结果显示,该片段与Bacillus subtilis菌株(登录号为OQ586633.1)的16S rRNA基因序列相似度达到了100%。基于16S rRNA基因序列的系统发育分析发现,Bacillus sp.C1R32与B.subtilis NBRC 13719(NR112629.1)和B.subtilis JCM 1465(NR113265.1)聚在同一最小分支(图3),因此将C1R32鉴定为枯草芽孢杆菌,将其命名为B.subtilis C1R32。
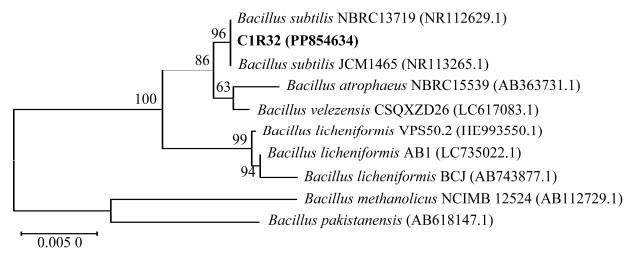
图3 Bacillus sp.C1R32菌株基于16S rRNA基因序列的系统发育树
2.3拮抗菌抑菌谱测定
抑菌谱检测结果显示,B.subtilis C1R32对多种植物病原菌具有抑制作用,其对Botryotinia fuckeliana抑菌率高达78.11%,对Colletrichum lagenarium、Botrytis cinerea、Cochiobolus sativus抑制率超过60.00%,对Colletotrichum gloeosporioides抑制率也超过50.00%,表明B.subtilis C1R32具有一定的广谱抑菌能力(表3)。
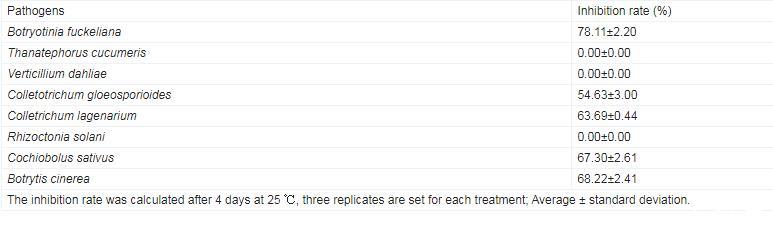
表3.Bacillus subtilis C1R32抑菌谱检测结果
2.4拮抗菌对桑椹菌核病的离体防效实验
B.subtilis C1R32对桑椹菌核病的离体防效检测结果表明,接种病原菌后第2天,纯水和LB液体培养基对照处理的桑椹均发病严重。B.subtilis C1R32菌悬液处理组桑椹病情指数为6.40,以纯水处理组(病情指数为13.60)为对照计算其防效为52.94%。B.subtilis C1R32发酵上清液处理组病情指数为12.00,以LB液体培养基处理组(病情指数为22.40)为对照计算其防效为46.43%。整体而言,B.subtilis C1R32对桑椹菌核病具有良好离体防效,并且菌悬液防效优于发酵上清液防效(表4)。
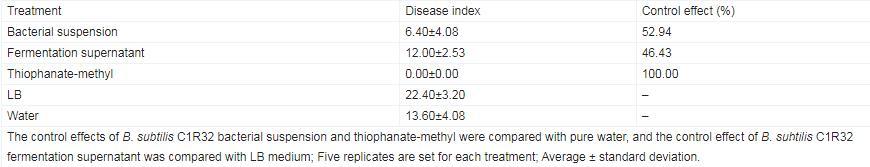
表4.Bacillus subtilis C1R32对桑椹菌核病的离体防效
2.5拮抗菌抑菌机理初探
2.5.1拮抗菌发酵上清液对病原菌菌丝生长抑制作用
病原菌在不同含量B.subtilis C1R32发酵上清液的PDA平板上均明显受到抑制,S.sclerotiorum PZ-2在含50%发酵上清液PDA平板上生长完全被抑制,虽然随着PDA平板中B.subtilis C1R32发酵上清液含量减少抑菌率逐渐下降,但含2%发酵上清液的PDA平板仍对S.sclerotiorum PZ-2有36.77%的抑制率(表5)。

表5.不同浓度Bacillus subtilis C1R32无菌发酵上清液对病原菌的抑制活性
光学显微镜观察B.subtilis C1R32发酵上清液对病原菌菌丝的生长抑制作用,结果显示,未用发酵上清液处理的病原菌菌丝粗壮,边缘整齐,尖端圆润,菌丝内容物均匀,菌丝呈现旺盛的生长趋势(图4A)。接种在含20%发酵上清液PDA平板上的S.sclerotiorum PZ-2菌丝变小,菌丝尖端膨大,内容物大量流出,菌丝生长滞缓(图4B);接种在含10%发酵上清液PDA平板上的S.sclerotiorum PZ-2菌丝断裂,尖端不生长,出现菌丝膨大现象(图4C,黄色箭头所指);接种在含5%发酵上清液PDA平板上的S.sclerotiorum PZ-2菌丝与对照组相比显著缩小,并呈现异常的弯折(图4D,蓝色箭头所指);接种在含3%和2%发酵上清液PDA平板上的S.sclerotiorum PZ-2菌丝细小,显示出异常的弯折生长(图4E、4F,蓝色箭头所指)。不同浓度B.subtilis C1R32发酵上清液处理后的病原菌菌丝生长均被抑制,并且发酵上清液含量较高时菌丝损伤较严重。
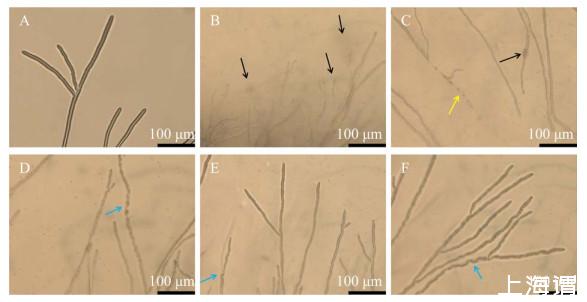
图4不同浓度Bacillus subtilis C1R32无菌发酵上清液对病原菌菌丝形态的影响
2.5.2拮抗菌对病原菌糖原积累的影响
利用KI-I2染色评估B.subtilis C1R32对S.sclerotiorum PZ-2糖原积累的影响。结果显示,KI-I2染色后,对照组PZ-2菌丝颜色随培养时间延长而加深(图5中A2),对峙培养的PZ-2菌丝颜色随培养时间的延长越来越浅(图5中B2),而且均比对照组颜色浅。此外,对峙培养的PZ-2菌丝细胞质减少,细胞破碎呈空壳状(图5,绿色箭头所指),隔膜明显增宽(图5中B1,蓝色箭头所指),并且随着对峙培养时间的延长,菌丝损伤程度逐渐增加,而对照组PZ-2菌丝并未出现明显损伤,结构完整,胞质均匀(图5中A1)。上述结果表明,B.subtilis C1R32影响S.sclerotiorum PZ-2糖代谢,使病原菌糖原积累量减少,同时影响S.sclerotiorum PZ-2细胞结构,使菌丝损伤。

图5 Bacillus subtilis C1R32对Sclerotinia sclerotiorum PZ-2糖原积累的影响
2.5.3拮抗菌对病原菌胞内活性氧的影响
通过DCFH-DA活性氧荧光探针染色测定B.subtilis C1R32对S.sclerotiorum PZ-2胞内活性氧的影响,结果显示,对照组菌丝呈现较弱绿色荧光(图6中A2);与C1R32对峙培养1、2、3 d的PZ-2菌丝荧光强度均强于对照组(图6中B2),对峙培养第2天的荧光最强,活性氧迸发后PZ-2菌丝出现损伤,呈现碎片状,至第5天则无法观察到荧光。此外,对照组菌丝均无明显破损(图6中A1),而与C1R32对峙培养的PZ-2菌丝损伤(图6中B1)。活性氧探针染色结果表明在作用早期,B.subtilis C1R32促使S.sclerotiorum PZ-2活性氧水平升高,产生氧化胁迫,导致其细胞损伤。
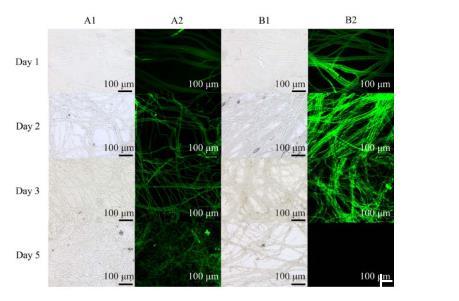
图6 Bacillus subtilis C1R32对Sclerotinia sclerotiorum PZ-2胞内活性氧积累的影响
2.5.4拮抗菌对病原菌基因表达的影响
由于拮抗菌影响S.sclerotiorum PZ-2糖原合成、活性氧爆发和细胞壁结构,因此通过实时荧光定量PCR对S.sclerotiorum PZ-2糖代谢、抗氧化酶和细胞壁成分相关基因的相对表达情况进行分析。结果显示,对峙培养24 h后,S.sclerotiorum PZ-2的糖代谢相关基因有下调表达的趋势,Gene_9536(己糖激酶)相对表达量为对照组的80.00%,Gene_7772(葡萄糖磷酸变位酶)表达量仅为对照组的34.00%,出现显著下调(P<0.001);此外,病原菌的抗氧化相关基因会上调表达,其中Gene_5305(过氧化氢酶相关的免疫反应性)表达量为对照组的3倍,Gene_4935(过氧化氢酶)表达量为对照组的3.4倍,均显著上调(P<0.05),Gene_1287(过氧化物酶体)的表达量显著(P<0.001)下调为对照组的51.00%;S.sclerotiorum PZ-2细胞壁组分相关基因Gene_13(糖基转移酶、纤维素酶)、Gene_622(细胞壁)的表达量与对照组相比分别上调了47.15%和78.75%,Gene_11361(几丁质合成酶2)的表达略有下调(图7)。基因表达量分析结果表明,B.subtilis C1R32会影响S.sclerotiorum PZ-2糖代谢相关基因表达,诱导S.sclerotiorum PZ-2抗氧化基因和细胞壁成分相关基因上调表达,这也与B.subtilis C1R32和S.sclerotiorum PZ-2对峙培养后的糖原染色和活性氧染色结果一致。
