本研究以革兰氏阴性菌Pseudomonas fluorescens CHA0、F113、Phl1c2、PF5与阳性菌Bacillus megaterium X14为研究对象,通过各菌株及菌株组合的溶磷能力评判组合效果,并进一步通过玉米盆栽试验验证其应用效果。
【方法】
通过菌株在NBRIP培养基中对难溶磷源Ca3(PO4)2的溶解能力评价各菌株及菌株组合的溶磷能力,测量接菌处理后的玉米干重、株高和全磷含量评价各菌株和菌株组合的盆栽应用效果。
供试菌株
4株荧光假单胞菌CHA0,F113,Phl1c2,PF5(G–),1株巨大芽孢杆菌X14(G+)。
5株菌均可以在以Ca3(PO4)2为难溶磷源的NBRIP液体培养基中生长溶磷,其中X14在培养基中溶磷能力较差,但定殖能力较强,盆栽应用效果较好。
菌生长量
将菌液低速(1500 r/min)离心3 min,然后取2 mL菌液用等体积1 mol/L HCl稀释,以去除上清液中残留的磷酸钙颗粒,600 nm处测定细菌生长量[18]。
结果与分析
溶磷菌及其复配组摇瓶实验结果
室内摇瓶试验中,分别测定了单株阴性菌、阳性菌、阴性菌与阴性菌组合以及阴性菌与阳性菌组合后,在NBRIP液体培养基中的溶磷量,OD600和pH值。结果表明(表1),各阴性菌发酵液中溶磷量均显著高于阳性菌株,其中最高为菌株PF5溶磷量可达到603.0μg/mL。比较生长量和培养基pH值发现,培养基中各阴性菌的增殖能力和降低pH的能力远高于阳性菌,其中菌株PF5生长最快(OD600=0.45),CHA0降低介质pH能力最强(pH=4.43,初始值为7.00)。将各阴性菌分别与和阳性菌X14组合后接种于培养基中,结果显示,发酵液中可溶磷含量均显著低于接种单株阴性菌的处理,且其生长量也明显降低。而不同阴性菌株相互组合后,其发酵液中可溶磷含量显著高于对应的阴性菌和阳性菌的处理。整体结果显示,在无机磷培养基中,阴性菌间的组合溶磷效果最优,其次是单株阴性菌,再次是阴性菌与阳性菌的组合,而阳性菌X14溶磷效果最差。
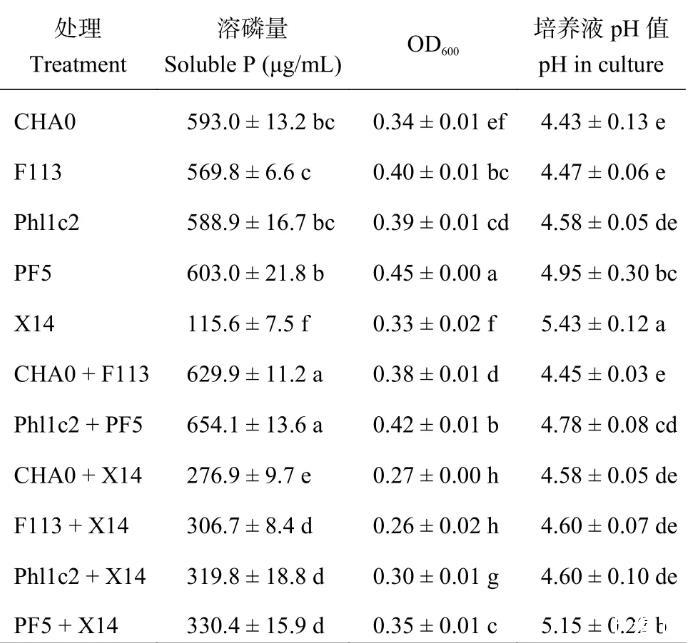
表1溶磷菌对Ca3(PO4)2的溶解能力
接种阴性菌株对玉米根系生长的影响
接种4株阴性菌株的玉米总干重结果表明,菌株PF5促进玉米生长效果最好,而测定玉米植株根系干重发现,接种菌株Phl1c2和PF5的玉米根系较为发达(图1),其中接种PF5效果最为突出,根系占玉米植株总干重的比例可达15.6%,其次为Phl1c2 14.6%,F113 13.2%,而菌株CHA0对玉米根系生长的效应最弱,只有12.3%。表明菌株Phl1c2和PF5对玉米根系生长的促进效应较为明显。
阴性菌株产促生物质的检测
通过检测4株阴性菌株发酵液中的促生物质(表2),发现菌株PF5以产IAA和GA为主,其中IAA含量最高,GA次之;铁载体A/Ar比值越低含量越高,Phl1c2的GA和铁载体含量均为最高值;菌株F113和CHA0产GA和IAA均为中等水平,其中CHA0产铁载体的能力高于菌株F113。生长素和赤霉素作为植物促生物质能够促进植物生长,且同时存在时有明显的协同效应,菌株通过分泌促生物质增加玉米根系生长,使其产生更多的玉米根系分泌物供根际微生物利用生长。
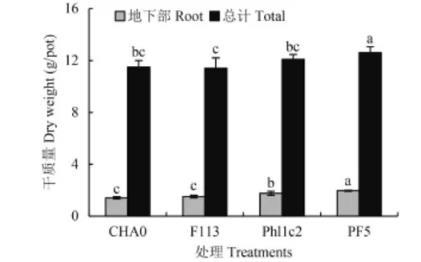
图1接种阴性菌对玉米干质量的影响
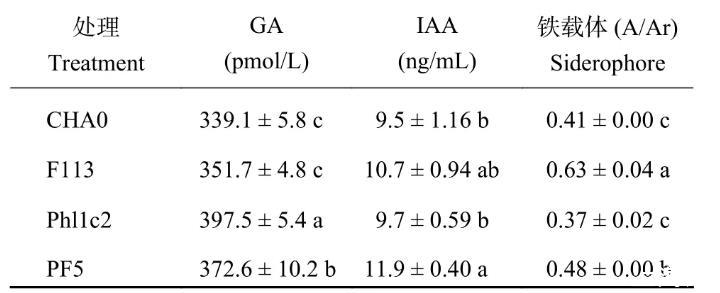
表2阴性菌株分泌的促生物质
【结果】
1)纯培养实验中CHA0、F113、Phl1c2、PF5在NBRIP无机磷液体培养基中可溶磷含量均显著高于X14,且4株阴性菌两两组合后,培养基中可溶磷含量显著高于对应的阴性菌与阳性菌的组合,即阴性菌组合后的溶磷效果高于阴性菌与阳性菌组合后的溶磷效果。2)单菌比较,盆栽试验接种阳性菌X14对玉米生长及全磷吸收累积量的效果与阴性菌的差异不及室内实验显著,说明该阳性菌盆栽应用效果较好。比较菌株组合的处理,发现接种阴性菌与阳性菌组合的处理,其对玉米生长及全磷吸收累积量的效果与接种对应的阴性菌组合的处理效果相近,甚至显著高于一些阴性菌组合。3)综合比较室内实验结果与盆栽试验结果,发现阳性菌X14虽然在培养基中溶磷效果差,但在盆栽试验中,无论是单菌还是与阴性菌组合后的处理均表现出了良好的溶磷效果,且部分阴性菌与该阳性菌配合后,在玉米盆栽应用中促生和溶磷效果最佳。
【结论】
与阴性菌组合相比,阳性菌与阴性菌组合室内溶磷效果均较差,但盆栽应用效果良好,甚至优于部分阴性菌组合,表明筛选溶磷菌株组合时,单一的室内纯培养结果不能作为唯一的评价指标,应同时结合盆栽的促生及溶磷效果。
相关新闻推荐
1、烟草青枯病菌的生长曲线及对不同复合药剂的敏感性测定(二)
3、枯草芽孢杆菌LBD-1形态特征、生长曲线、抗逆性及发酵后饲料特性(三)
